Атопический дерматит патогенез у детей
Атопический
дерматит (АД) —
хронигеское аллергигеское заболевание
кожи, которое развивается у лиц с
генетигеской предрасположенностью к
атопии.
Рецидивирующее
течение, характеризуется экссудативными
и/или лихеноидными высыпаниями,
повышением уровня сывороточного IgE
и гиперчувствительностью к
специфическим и неспецифическим
раздражителям.
Этиология.
1)наследственность
2)
аллергены. ( домашней пыли, эпидермальных,
пыльцевых, грибковых, бактериальных и
вакцинальных аллергенов)
3)
неаллергенным причинным(психоэмоциональные
нагрузки; изменения метеоситуации;
пищевые добавки; поллютанты; ксенобиотики.)
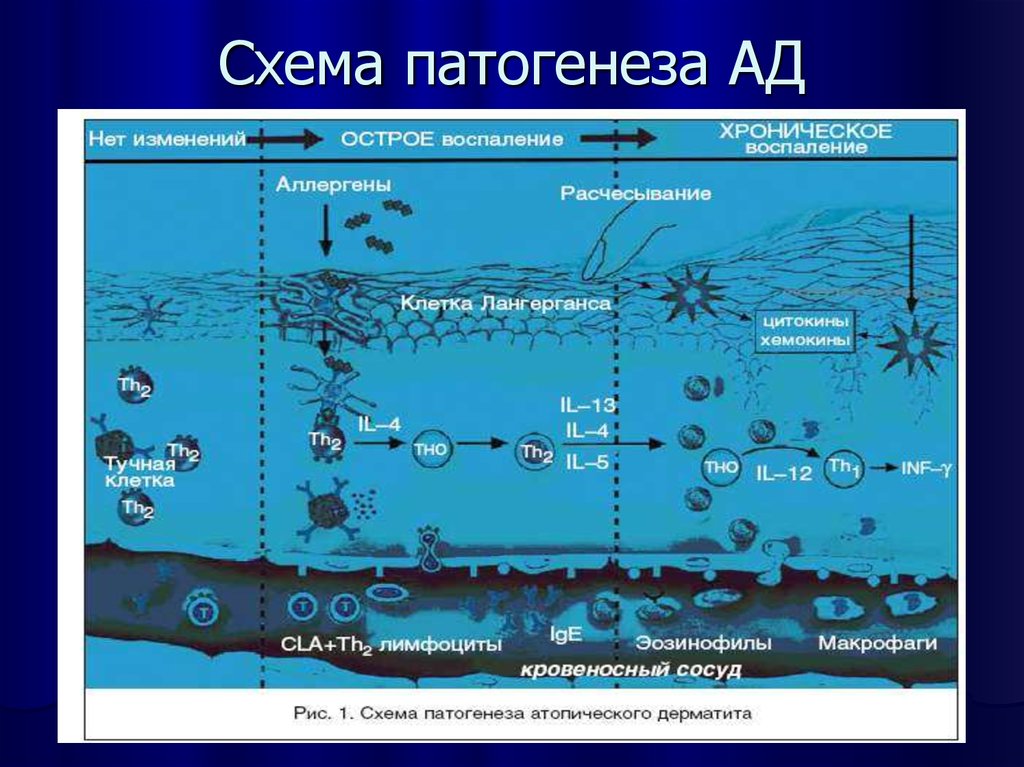
Патогенез.
иммунологический патогенез:.
Клетки
Лангерганса(выполняют функцию
антигенпрезентирующих) внутри эпидермиса
образуют в межклеточном пространстве
равномерную сеть между кератиноцитами.→
На их поверхности R
для молекулы IgE.→При
контакте с антигеном → перемещаться
в дистально и проксимально расположенные
слои тканей.→вступают во взаимодействие
с ThO-лимфоцитами,
которые дифференцируются в Thl-
и Тh2-клетки.
Тh2-клетки
способствуют образованию В-лимфоцитами
специфических IgE-антител
и их фиксации на тучных клетках и
базофилах.Повторный
контакт с аллергеном приводит к
дегрануляции тучной клетки и развитию
немедленной фазы аллергической реакции.
За ней следуетIgE-зависимая
поздняя фаза реакции, характеризующаяся
инфильтрацией тканей лимфоцитами,
эозинофилами, тучными клетками,
нейтрофилами, макрофагами.
• Далее
воспалительный процесс приобретает
хроническое течение. Зуд кожи, который
является постоянным симптомом АД,
приводит к формированию зудо-расчесочного
цикла: кератоциты, повреждаемые при
расчесывании, высвобождают цитокины
и медиаторы, которые привлекают клетки
воспаления в очаг поражения.
.
Почти у 90%, больных АД, имеется колонизация
кожных покрововStaph,
aureus,
способного обострять или поддерживать
кожное воспаление посредством секреции
токсинов суперантигенов, стимулирующих
Т-клетки и макрофаги. Около половины
детей с АД продуцируют IgE-антитела
к стафилококковым токсинам.
Клиническая
картина.
разнообразные проявления — папулы,
небольшие эпидермальные везикулы,
эритематозные пятна, шелушение, струпья,
трещины, эрозии и лихенизация. Характерный
признак— сильный зуд.
У
детей грудного возраста
(младенческая форма — до 3 лет) элементы
расположены преимущественно на лице,
туловище, разгибательных поверхностях,
волосистой части головы.В
возрасте 3—12 лет
(детская форма) — на разгибательных
поверхностях конечностей, лице, в
локтевых и подколенных ямках.При
подростковой форме
(12—18 лет) поражаются шея, сгибательные
поверхности конечностей, запястья,
верхние отделы груди.У
людей молодого возраста —
шея, тыльная поверхность кистей.
Часто
→ участки гипопигментации на лице и
плечах (белый лишай); характерную
складку по краю нижнего века (линия
Денье—Моргана); усиление рисунка
линий ладони (атопические ладони); белый
дермографизм.
Степень
тяжести АД определяют по международной
системе SCORAD
с учетом объективных симптомов, площади
поражения кожи, оценки субъективных
признаков (зуд и нарушение сна).
АД
часто осложняется вторичн бактериальной
(стафило и стрептококки) инфекцией.
Диагностика.
1)анамнез (начало заб-ния в раннем
возрасте; наследственность; зуд ;типичная
морфология кожных высыпаний; типичная
локализация кожных высыпаний; хроническое
рецидивирующее течение;
2)высокий
уровень общего IgE
и аллерген-специфических IgE-антигенов
в сыворотке.
3)
Прик-тест или кожные скарификационные
пробы
4)диагностику
in
vitro.
5)элиминационно-провокационные
пробы с пищевыми продуктами.
Дифференциальный
диагноз
проводят с себорейным дерматитом;
синдромом Вискотта—Олдрича , синдромом
гипериммуноглобулинемии Е , микробной
экземой;
Лечение.
1)диетотерапия.
элиминационная диета (исключение
провокационных продуктов, ограничение
сахара, соли , бульонов, острых, соленых
и жареных блюд,
2)
элиминация бытовых аллергенов.
3)Системное
лечение
→антигистаминные
препараты
I,
II и III поколения (зиртек, кларитин,
кетотифен, телфаст).
→
мембраностабилизирующим
препаратам (кетотифен,
ксидифон, антиоксиданты , налкром.
Витамины)
→
препаратов
кальция
(глюконат, лактат, глицерофосфат по
0,25—0,5 внутрь 2—3 раза в день)
→
фитотерапия
(корень солодки, стимулирующий
функцию надпочечников и его препарат
глицирам и др.).
→
пищеварительных
ферментов
(фестал, дигестал, панкреатин и др.),
→При
выраженной пиодермии →
антибактериальной терапии
( макролидам, цефалоспоринам I и II
поколения, линкомицину.)
4)Наружная
терапия:
→ Ногти
на пальцах рук у ребенка должны быть
коротко острижены,
→
индифферентные
пасты, мазей, болтушек, содержащих
противовоспалительные, кератолитические
и керато пластические средства. жидкостью
Бурова (раствор алюминия ацетата), 1%
раствора танина и др.
→При
выраженных проявлениях → глюкокортикостероиды
( элоком (крем, мазь, лосьон), адвантан
(эмульсия, крем, мазь).
→
наружные
антибактериальные препараты
(бактробан, 3—5% пасты с эритромицином,
линкомицином). →обрабатывают
фукорцином, раствором бриллиантового
зеленого, метиленового синего.
Прогноз.
Полное клиническое выздоровление
наступает у 17—30% больных.
3.
Ожирение.
Ожирение — неоднородное по происхождению
заболевание обусловленное накоплением
триглицеридов в жировых клетках и
проявляющееся избыточным жироотложением.
Частота — 5%, встречается чаще у девочек.
Этиология
и патогенез. Избыт жироотлож возникает
в рез-те несоответствия баланса
поступления пищи и расхода энергии в
сторону преобл первого. Предраспол
факторы- врожденно обусл повыш содержания
в организме жировых клеток(адипоцитов),
особенности жирового обмена с
преобладанием процессов липогенеза
над липолизом; эндокринные
нарушения(гипотиреоз, гипогонадизм,
гиперкортицизм и др.); поражение
гипоталамуса(родовая травма, инфекции,
гипоксия головного мозга и т.д.).
Клиника.
Ожирение- избыток массы тела превыш
10% от должной по дл тела, избыток дб
обусл-н жировым компонентом сомы, а не
мышечным и костным. Для более точной
оценки степени избытка жировой ткани
в организме используют измерение кожных
складок калипером.
Наиболее
часто встречается
конституциально-экзогенная(простая)
форма ожирения, составляющая до 90% от
всех форм избыточного питания у детей.
Наличие с детского возраста ожирения
создает предпосылки для формирования
в дальнейшем таких заболеваний, как:
атеросклероз, гипертоническая болезнь,
сахарный диабет II типа, желчекаменная
болезнь и пр. также формы ожирения-
гипоталамическая, синдром иценко –
кушинга, пубертатный гипоталамический
синдром.
Лечение
конституционально-экзогенной формы
ожирения. Основным методом лечения
является диетотерапия. При умеренном
ожирении калорийность рациона сокращается
на0-30%, при выраженном — на 45-50%, энергоемкость
пищи снижается преимущественно за счет
легкоусваиваемых углеводов, частично
жиров. Количество белков в суточном
рационе должно соответствовать
потребностям здорового ребенка этого
же возраста. Суточная калорийность
рациона школьника, страдающего выраженным
ожирением обычно составляет около 500
ккал. Большое значение имеет лечебная
физкультура, психологическая установка
пациента(мотивация).
Профилактика.
Рациональные режим дня и питания
беременной,а также в раннем возрасте
ребенка имеют большое значение в
профилактике простой формы ожирения,
так как переедание беременной и
нерациональное кормление(углеводистый
перекорм) ребенка на первом году жизни
приводит к увеличению числа жировых
клеток в организме последнего, что
создает предпосылки для развития у
него в даль нейшем ожирения.
Билет
23
1.
АСФИКСИЯ
Традиционно рекомендуют ориентироваться
на оценку Апгар через 1 мин после
рождения. Если ребенок набирает 0-3
балла, то показана срочная реанимация
К
факторам, наиболее часто приводящих к
асфиксии относятся:
A.
В пренатальном периоде: гестозы
беременных, кровотечения и инфекционные
заболевания во 2-м и 3-м триместре,
многоводие или малое количество
околоплодных вод, переношенная или
многоплодная беременность, сахарный
диабет матери, задержка внутриутробного
развития плода.
Б.
В интранатальном периоде: кесарево
сечение (плановое, экстренное), аномальное
предлежание плода, преждевременные
роды, безводный промежуток более 24 ч,
быстрые (менее 6 ч) или затяжные (более
24 ч) роды, затяжной второй период родов
(более 2 ч), аномальная частота пульса
плода, общий наркоз у матери, наркотические
анальгетики, введенные матери менее,
чем за 4 ч до родов; меконий в амниотических
водах, выпадание узла пуповины и обвитие
её, отслойка плаценты, предлежание
плаценты;
B.
Лекарства, используемые беременной:
наркотические вещества, резерпин,
антидепрессанты, сульфат магния,
адреноблокаторы.
1
этап реанимационных мероприятий.
Основная
задача этого этапа — быстрое
восстановление проходимости дыхательных
путей.
Сразу
при рождении головы отсосать катетером
содержимое из полости рта. Если после
рождения ребенок не дышит, надо провести
нежную стимуляцию-щелкнуть по подошве,
энергично обтереть спину и далее
пережать пуповину двумя зажимами Кохера
и перерезать её. Положить ребёнка на
стол под источник тепла с опущенным
головным концом (около 15°). Обтереть
его теплой стерильной пеленкой и сразу
же удалить её (для предупреждения
охлаждения). Провести санацию верхних
дыхательных путей (грушей, катетером),
в положении ребенка на спине со слегка
запрокинутой головой («поза для
чихания»). Если в околоплодной жидкости
и в дыхательных путях младенца выявлен
меконий, незамедлительно провести
интубацию с тщательной последующей
санацией трахеобронхиального дерева.
В конце этого этапа реанимации,
длительность которого не должна
превышать 20 с, следует оценить дыхание
ребенка. При появлении у ребенка
адекватного дыхания (после санации или
стимуляции) следует сразу же определить
частоту сердечных сокращений (ЧСС) и,
если она выше 100 в мин и кожные покровы
розовые, прекратить дальнейшие
реанимационные мероприятия и организовать
наблюдение (мониторинг) в последующие
часы жизни. Если в этой ситуации кожные
покровы цианотичные, надо начать давать
кислород маской и попытаться определить
причину цианоза. Наиболее часто общий
цианоз обусловлен гемодинамическими
нарушениями (артериальная гипотония,
врожденный порок сердца), поражением
легких (внутриутробная пневмония,
массивная аспирация, пневмоторакс,
синдром дыхательных расстройств,
диафрагмальная грыжа, незрелость
легких), ацидозом. При отсутствии
самостоятельного дыхания или его
неэффективности приступить ко II
этапу реанимации, задачей которого
является восстановление внешнего
дыхания,
ликвидация
гипоксемии и гиперкапнии.
Для этого нужно начать искусственную
вентиляцию легких (ИВЛ) через маску
дыхательным мешком (Амбу, Пенлон, РДА-I
и др.), тщательно следя за давлением
вдоха (первые 2-3 входа с давлением 30-35
см вод. ст., последующие-20-25 см.) и
экскурсиями грудной клетки. В начале
ИВЛ используют 60% О2.
Хорошие
экскурсии грудной клетки свидетельствуют
о достаточной или даже избыточной
вентиляции альвеол, а также об отсутствии
у больного серьёзных проблем, связанных
с нарушением проходимости дыхательных
путей и поражением легочной ткани.
Недостаточные экскурсии грудной клетки
при ИВЛ могут быть обусловлены как
нарушением проходимости верхних
дыхательных путей (западение языка и
нижней челюсти, обструкция носовых
ходов и носоглотки, чрезмерное
переразгибание шеи, пороки развития),
так и поражением легочной паренхимы
(жесткие легкие). Одновременно с ИВЛ
оцените возможность медикаментозной
депрессии и при её . вероятности
стимулируйте дыхание внутривенным
введением налорфина или этимизола.
Через
20—30 с после начала ИВЛ необходимо
определить частоту сердечных сокращений
за 6 секунд и умножить на 10. В
ситуации, когда частота серцебиений
находится в пределах 80-100, продолжают
вентиляцию легких до тех пор, пока она
не возрастёт до 100 и более в мин.
Наличие самостоятельного дыхания при
этом не является поводом к прекращению
ИВЛ. III
этап реанимации — т е р а п и я
гемодинамических
расстройств.
Если
частота сердечных сокращений не
увеличивается или даже снижается ниже
80 в минуту, необходимо срочно начать
закрытый массаж сердца (ЗМС) на фоне
ИВЛ маской со 100% концентрацией кислорода.
Если в течение 20-30 с массажа эффекта
нет — интубировать больного и продолжать
ИВЛ с ЗМС. Если и эти мероприятия в
течение следующих 30 с не купировали
тяжелую брадикардию, следует ввести
эндотрахеально 0,1-0,3 мл/кг 0,01% раствора
(!) адреналина (разводят равным количеством
изотонического раствора натрия хлорида)
и продолжают ИВЛ с ЗМС. Вслед за этим,
катетеризируют пупочную вену, измеряют
артериальное давление, оценивают
состояние микроциркуляции (симптом
«белого» пятна), цвет кожных покровов.
В зависимости от ситуации проводят
комплексную терапию брадикардии
(адреналин, изадрин повторно), артериальной
гипотонии (волемические препараты: 5%
р-р альбумина, изотонический раствор
натрия хлорида, раствор Рингера, нативная
плазма; допамин в дозе 5 мкг/кг/мин и
выше), ацидоза (2% р-р гидрокарбоната
натрия в дозе 4-5 мл/кг). Симптом «белого
пятна», держащийся более 3 с, признак
гиповолемии у только что родившегося
ребенка.
Длительность
реанимации при стойкой, тяжелой
брадикардии и отсутствии дыхания,
рефрактерных к интенсивной терапии,
не должна превышать 15-20 мин, так как в
этом случае возможны глубокие и
необратимые повреждения головного
мозга.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Атопический дерматит является распространенным заболеванием, на долю которого приходится половина случаев в общей структуре аллергической патологии с тенденцией к дальнейшему увеличению. Понять суть болезни можно лишь при рассмотрении причин и механизмов, участвующих в ее развитии. Поэтому при атопическом дерматите этиология и патогенез заслуживают пристального внимания.
Предрасполагающие факторы
Причины и условия, способствующие развитию болезни, рассматриваются в рамках раздела медицины, известного как этиология. Атопический дерматит возникает на фоне повышенной чувствительности организма к различным аллергенам, окружающим человека в повседневной жизни. Ими становятся следующие:
- Пищевые (яйца, морепродукты, орехи, цитрусовые, клубника).
- Растительные (пыльца, пух).
- Животные (шерсть, перья, клещи, укусы насекомых).
- Бытовые (пыль).
- Химические (моющие средства, синтетические ткани).
- Лекарственные (практически любые медикаменты).
Это вещества, которые становятся сенсибилизаторами и запускают развитие в организме патологических процессов. Все это происходит на фоне предрасположенности к такому типу реакций, которая формируется на генетическом уровне. При семейном анамнезе заболевания у обоих родителей риск дерматита у ребенка находится на уровне 60–80%, если же кожное поражение было у одного из них, то вероятность наследственно обусловленного заболевания снижается до 40%. Однако и без явных семейных случаев
Кроме того, в развитии атопического дерматита отмечается роль и других этиологических факторов эндогенной природы:
- Гельминтозов.
- Гормональных и обменных сбоев.
- Нейроэндокринной патологии.
- Расстройств пищеварения.
- Интоксикаций.
- Стрессовых состояний.
Заболевание возникает чаще всего уже в раннем детском возрасте, в условиях экссудативно-катарального диатеза, нарушений питания, экзематозных процессов. Они, наряду с генетической предрасположенностью, формируют предпосылки для атопического дерматита. Поэтому такие состояния нуждаются в своевременном выявлении у ребенка и полноценной коррекции, что позволит снизить риск развития болезни.
Выявление причин и факторов, способствующих развитию аллергического дерматоза – это основной аспект в его устранении. А значит, вопросам этиологии атопического дерматита следует уделять должное внимание.
Механизмы развития

Патогенезом называют раздел медицинской науки, изучающий механизмы, по которым идет развитие болезни. Основополагающее значение при атопическом дерматите имеют иммунопатологические процессы. Аллерген провоцирует в организме выработку антител (иммуноглобулинов класса E), которые расположены на клетках Лангерганса в коже. Последних у пациентов с рассматриваемым дерматозом значительно больше, чем обычно.
Клетки Лангерганса представляют собой тканевые макрофаги, которые после поглощения и расщепления антигена презентируют его лимфоцитарному звену. Далее происходит активация T-хелперов, которые вырабатывают цитокины (особенно ИЛ-4). Следующим этапом иммунного механизма идет сенсибилизация B-лимфоцитов, преобразующихся в плазматические клетки. Именно они и синтезируют специфические иммуноглобулины (антитела к аллергену), которые откладываются на клеточной мембране. При повторном контакте с аллергеном происходит дегрануляция тучных клеток и выделение из них биологических веществ (гистамин, простагландины, лейкотриены, кинины), инициирующих повышение сосудистой проницаемости и воспалительные реакции. В эту фазу наблюдаются покраснение кожи, отечность и зуд.
Выделение факторов хемотаксиса и интерлейкинов (ИЛ-5, 6, 8) стимулирует проникновение в патологический очаг макрофагов, нейтрофилов и эозинофилов (включая длительно живущие виды). Это становится определяющим фактором в хронизации дерматоза. А в ответ на длительный воспалительный процесс в организме уже вырабатываются иммуноглобулины G.
Патогенез атопического дерматита также характеризуется снижением супрессорной и киллерной активности иммунной системы. Резкое повышение уровней Ig E и Ig G, наряду со снижением уровня антител класса M и A, приводит к развитию кожных инфекций, нередко принимающих тяжелое течение.
В процессе исследований механизмов развития атопического дерматита было выявлено снижение экспрессии DR-антигенов на поверхности моноцитов и B-лимфоцитов, в то время, как T-лимфоциты, наоборот, имеют более плотное расположение подобных молекул. Также определена ассоциация заболевания с определенными антигенами главного комплекса гистосовместимости (A1, A9, A24, B12, B13, D24), по которым можно предполагать о высоком риске развития дерматита у пациента.
Немаловажное значение в появлении патологии отводится эндогенной интоксикации, возникающей из-за ферментопатии пищеварительного тракта. Это ведет к нейроэндокринным нарушениям, дисбалансу в калликреин-кининовой системе и обмене катехоламинов, синтезе защитных антител.
На фоне аллергического воспаления в коже происходит повреждение эпидермиса и водно-жирового слоя. Через кожу увеличивается потеря жидкости, из-за чего она становится пересушенной, усиливаются процессы ороговения (гиперкератоз), появляются шелушение и зуд. А из-за снижения барьерных функций повышается риск вторичного инфицирования.
Изучение патогенеза аллергического дерматоза дает массу важных сведений о развитии и течении болезни, необходимых для понимания сути проблемы.
Этиопатогенез атопического дерматита включает информацию о причинах, факторах возникновения и механизмах, по которым развивается патология. Именно эти аспекты играют определяющую роль в формировании терапевтической стратегии, ведь для избавления от болезни нужно устранить контакт с аллергеном и разорвать иммунопатологические процессы.
Источник


