Декспантенол при атопическом дерматите отзывы
Атопический дерматит – важнейшая медико-социальная проблема современности. Это определяется высокой распространенностью данного заболевания среди детей, тяжестью его течения, снижением качества жизни больных, неудовлетворительными результатами лечения [1]. В подавляющем большинстве (60–85%) случаев атопический дерматит возникает в первые годы жизни. У взрослых он отмечается в 16,8% случаев, прослеживается тенденция к росту распространенности этого заболевания у подростков [2]. Как правило, истоки атопического дерматита у взрослых лежат в детском возрасте, и под влиянием ряда неблагоприятных факторов заболевание дебютирует в старшем возрасте.
В последние годы среди пациентов с атопическим дерматитом регистрируются высокая частота госпитализаций, короткие ремиссии болезни и незапланированные обращения к врачам, а также высокий риск развития бактериальной, грибковой и вирусной инфекции. Предопределяется это тем, что мультифакториальная концепция патогенеза атопического дерматита обосновывает применение широкого спектра лечебных мероприятий, которые в ряде случаев могут иметь противоречивый характер. Незнание современных этиологических факторов и механизмов развития атопического дерматита зачастую приводит к врачебным ошибкам как в диагностике, так и в назначении адекватного (рационального) лечения. Следует отметить, что терапия атопического дерматита до сих пор представляет собой сложную проблему ввиду особенностей патогенеза заболевания, многообразия фенотипических проявлений и стадийности клинического течения. Хорошо известно, что с возрастом меняется характер клинических проявлений атопического дерматита, изменяются клинико-морфологические признаки болезни [3].
Попытки разработать четкие дифференциально-диагностические критерии различных фенотипов атопического дерматита продолжаются по сей день. В настоящее время выделяют 2 основных иммунопатогенетических фенотипа атопического дерматита: иммуноглобулин Е (IgE) -зависимый (экзогенный) и IgE-независимый (эндогенный). Экзогенная (аллергическая) форма атопического дерматита характеризуется ранним началом, повышением уровня общего IgE в сыворотке крови, наличием аллергенспецифических IgE антител к пищевым и другим аллергенам, высокими значениями интерлейкина (IL)-4, IL-13 [4]. Часто сочетается с другими аллергическими заболеваниями (бронхиальная астма, аллергический ринит) и встречается у 80–85% детей. При неаллергической (эндогенной) форме атопического дерматита уровень общего IgE в сыворотке крови остается в пределах нормы, отмечаются низкие показатели IL-4, IL-13, IL-5 и высокие показатели интерферона. Клиническими особенностями являются позднее начало, среднетяжелое течение болезни, наличие складки Моргана (глубокая складка на нижнем веке), отсутствие выраженной сухости и ладонной исчерченности. Частота эндогенной формы у детей составляет 15–20%. Она является наименее изученным вариантом атопического дерматита.
Атопический дерматит относится к мультифакториальным заболеваниям, в развитии которых большое значение имеют генетические факторы – на них, в свою очередь, влияют различные факторы окружающей среды. В настоящее время известны гены и гены-кандидаты, ответственные за развитие атопического дерматита. Описано более 20 генов, ассоциируемых с атопической предрасположенностью. Это такие гены, как ADAM33, SPINK5, FLG и многие другие [5–7]. Особый интерес заслуживает область на 5-й хромосоме (5q31-33), содержащая кластер генов IL-3, IL-4, IL-5, IL-13, GM-CSF. Связь с атопическим дерматитом была обнаружена и на хромосоме 3q21, содержащей ко-стимуляторные молекулы CD80 и CD86, вовлеченные в активацию Т-клеток. В хромосоме 5q был обнаружен ген SPINK5, который кодирует ингибитор сериновой протеазы. Этот белок играет важную роль в разных морфофизиологических процессах в коже (противовоспалительных и антимикробных), контролирует дифференцирование эпителия и клеток, регуляцию ангиогенеза и клеточную адгезию. В последние годы выявлен еще один ген, мутации в котором приводят к нарушению барьерной функции кожи, делая ее более чувствительной к действию микроорганизмов (таких как Staphylococcus aureus и Malassezia). Мутации в гене FLG, приводящие к полной или частичной потере филаггрином своей функции, повышают чувствительность кожи к действию внешних факторов [8, 9]. Мутация в генах филаггрина R501X и 2282dell4 является фактором, предрасполагающим к тяжелому течению атопического дерматита [10]. Все эти данные свидетельствуют о полигенном наследовании атопического дерматита.
Таким образом, в патогенезе данного заболевания важную роль играют нарушение барьерной функции кожи и патологические изменения со стороны иммунной системы – оба эти фактора генетически детерминированы. Результаты последних исследований указывают на значимость нарушений кожного барьера и врожденной особенности функционирования иммунной системы, проявляющейся усиленным иммунным ответом на аллергены и микробные антигены. В последние годы интенсивно изучаются антимикробные пептиды, в частности кателицидин (LL-37), -deensin-2 (BD-2), уровни которых в коже у больных атопическим дерматитом снижены. Антимикробные липиды (глюкозилцерамиды, свободные сфингозины) в роговом слое эпидермиса также обеспечивают антимикробную защиту организма. Антимикробные пептиды (BD-2, LL-37) обычно синтезируются кератиноцитами в ответ на воспалительный стимул, например при псориатических поражениях или механическом повреждении кожи, однако у больных атопическим дерматитом способность к усилению синтеза антимикробных пептидов снижена [11]. Таким образом, несовершенство кожного барьера вследствие мутации гена, детерминирующего синтез филаггрина и снижение антимикробных пептидов, таких как LL-37, DD-2 и 3, стали рассматриваться как ключевые факторы патогенеза атопического дерматита. Ослабление барьерной функции кожи с избыточной потерей влаги приводит к повышению проницаемости кожи для аллергенов, антигенов и веществ окружающей среды, вследствие чего развивается воспалительная кожная реакция.
Механизм развития зуда, который у больных атопическим дерматитом является одним из кардинальных симптомов, до конца не выяснен. Выброс гистамина не является единственной причиной возникновения зуда, поэтому антигистаминные препараты нового поколения, не обладая седативным эффектом, не всегда эффективны. Очень важно при лечении атопического дерматита купировать зуд, поскольку механическое повреждение кожи при расчесывании индуцирует выброс провоспалительных цитокинов и хемокинов, картина болезни усугубляется, формируется порочный круг. В связи с этим актуальным является поиск новых решений и путей купирования зуда у больных атопическим дерматитом.
Лечение атопического дерматита.
Общие рекомендации
Ведение больных атопическим дерматитом представляет собой сложную задачу. В первую очередь необходимо преодолеть тот психологический барьер, который возникает между родителями ребенка с атопическим дерматитом и лечащим врачом. В большинстве случаев родители ждут быстрого эффекта и не всегда кропотливо выполняют ежедневные процедуры. Очень важно убедить родителей в необходимости длительной терапии и мотивировать их на выполнение рекомендаций по контролю над течением болезни. Поздняя диагностика и связанная с ней неадекватная терапия, отсутствие преемственности между врачами и четкого регулирования оказания соответствующей медицинской помощи являются причинами неэффективности лечения, что негативно отражается на качестве жизни больных.
Дети с атопическим дерматитом должны постоянно проходить осмотр аллерголога или дерматолога, которые проводят коррекцию терапии, меняют тактику ведения больного в зависимости от стадии болезни и наличия сопутствующих заболеваний и осложнений.
С целью профилактики обострений атопического дерматита у детей необходимо обучение родителей: обеспечение их полной информацией о причинах заболевания, характере его течения, особенностях лечения и возможностях противорецидивной терапии.
В настоящее время лечение атопического дерматита у детей рекомендуется сопровождать следующими терапевтическими мероприятиями:
1. Диетотерапия на основании результатов аллергологического обследования. Назначение персонифицированных диет.
2. Элиминационные мероприятия, направленные на устранение или уменьшение воздействия факторов, вызывающих обострение болезни. В числе профилактических мер пациентам рекомендуется избегать средств, раздражающих кожу, например изделий из синтетических, шерстяных материалов, детергентов и моющих средств с pH 5,5. Следует избегать воздействия холодового и теплового факторов, избыточной психоэмоциональной и физической нагрузки.
3. Купирование острых проявлений заболевания.
4. Базисная (противорецидивная) терапия, контролирующая течение атопического дерматита.
5. Терапия сопутствующих заболеваний.
6. Коррекция иммунологических нарушений, сопровождающих атопический дерматит (по строгим показаниям).
К увлажняющим средствам, предотвращающим трансэпидермальную потерю воды, относятся препараты старого поколения: вазелин, парафин, воск, ланолин и другие животные жиры. Они блокируют прохождение жидкости через роговой слой. В состав увлажняющих средств могут быть включены вещества, способные притягивать и удерживать воду: глицерин, сорбит, гиалуроновая кислота, гель алоэ, органические кислоты. Увлажняющие средства нового поколения содержат натуральные растительные вещества, ретиноиды, коллаген, эластин, лецитин, церамиды. Эффективность увлажняющих средств доказана во многих многоцентровых исследованиях. Базисная противорецидивная терапия предусматривает также ежедневный уход за кожей с использованием увлажняющих и смягчающих средств. Они смягчают сухую зудящую кожу, улучшают качество жизни больных атопическим дерматитом. Таким образом, терапия атопического дерматита носит комплексный патогенетический характер из-за гетерогенности механизмов развития и клинических проявлений.
Появление на российском рынке многочисленных новых средств по уходу за кожей, позволяющих поддерживать кожу ребенка с атопическим дерматитом в чистом и увлажненном состоянии ставит перед практическими врачами задачу их адекватного и целенаправленного назначения. Для коррекций нарушений со стороны эпидермального барьера требуются увлажнение, питание и защита кожи. Эта система предполагает использовать средств ежедневного и специального ухода. Среди них особую актуальность приобретают препараты, улучшающие барьерную функцию кожи и кровоток в очагах поражения, средства, оказывающие успокаивающее действие, питающие и смягчающие кожу. Назначают их соответственно возрасту ребенка, периоду заболевания с учетом характера поражения кожи.
Особенно важно сочетанное применение наружных средств, воздействующих на зуд и сухость кожных покровов. В таких случаях возможно применение топических кортикостероидов с увлажняющими и смягчающими средствами или сочетанное использование нестероидных противовоспалительных препаратов со средствами по уходу за кожей.
Для устранения сухости кожи существует целый свод правил, в который входит ежедневное проведение общих гигиенических ванн с оптимальной температурой воды 30–32оС. Такие ванны не только очищают и увлажняют кожу, но и усиливают проникновение лечебных препаратов, предотвращают инфицирование кожи, улучшают самочувствие и доставляют ребенку удовольствие. Вода для купания должна быть дехлорированной (используются фильтры или отстаивание воды в ванне в течение 1–2 ч с последующим согреванием или добавлением кипятка) и прохладной. При этом для мытья ребенка стараются применять высококачественные моющие средства с нейтральным рН=5,5, которые не нарушают водно-липидный баланс эпидермиса, а также его барьерные функции. Сразу после ванны на еще влажные пораженные и свободные от воспаления участки наносят специальные смягчающие средства ухода за кожей, предназначенные для детей с атопическим дерматитом. Они способствуют образованию жировой пленки на поверхности кожи, которая препятствует испарению воды и обеспечивает защиту кожи от вредных внешних раздражителей. Использовать их необходимо регулярно (2–4 р./сут), для того чтобы кожа оставалась мягкой в течение всего дня.
Известно, что сухость кожи связана с нарушением ее барьерной функции. Использование увлажняющих средств уменьшает трансэпидермальную потерю воды через кожу, делая ее менее чувствительной к различным раздражителям и аллергенам. Смягчающие средства влияют на внеклеточную мембрану эпидермиса и усиливают антимитотические процессы в коже. Эффективность увлажняющих/смягчающих средств в настоящее время интенсивно изучается. Исследованиями последних лет доказана важная роль применения увлажняющих средств в острой и хронической фазах атопического дерматита. Гидратация кожи значительно повышает эффективность комплексной терапии данного заболевания, позволяет улучшить качество жизни таких больных и уменьшить потребность в фармакологических препаратах.
Появление на российском рынке многочисленных новых средств ухода за кожей, позволяющих поддерживать кожу ребенка с атопическим дерматитом в чистом и увлажненном состоянии, ставит перед практическими врачами задачу адекватного и целенаправленного назначения таких средств. Так, разрабатываются и активно внедряются программы по уходу за кожей ребенка с атопическим дерматитом, куда входят термальные воды, специализированные мыла, муссы, молочко, кремы, мази, эмульсии, шампуни. Среди них особую актуальность приобретают препараты, устраняющие зуд кожных покровов; смягчающие и увлажняющие кожу; улучшающие кровоток в очагах поражения, а также улучшающие барьерные функции кожи. Назначают их с учетом возраста ребенка, периода заболевания и характера поражения кожи.
Одним из современных смягчающих средств, используемых в наружной терапии детей с сухой, поврежденной и раздраженной кожей, является декспантенол, действующим веществом которого является провитамин пантотеновой кислоты (В5). Препарат усиливает метаболическую активность клеток кожи, вовлеченных в процесс регенерации, стимулирует эпителизацию кожи, служит источником нейтральных жиров, восстанавливает поврежденный эпидермис, улучшает его барьерную функцию, оказывает противовоспалительное действие. Пантотеновая кислота участвует в образовании антител и обеспечивает защиту кожи от вредных внешних факторов.
С целью определения эффективности и переносимости этого лекарственного средства при наружной терапии атопического дерматита у детей был использован декспантенол – был использован Бепантен. Активным веществом его является декспантенол. В состав Бепантена также входят ланолин, протегин Х, цетиловый спирт, миндальное масло и жидкий парафин. Выпускается он в форме мази и крема, а также в виде крема, содержащего хлоргексидин.
Оценка эффективности декспантенола (Бепантен) проводилась у детей, находившихся в отделение аллергологии ФГБУ «НИИ питания» РАМН. Под нашим наблюдением находилось 25 детей в возрасте от 6 мес. до 3-х лет в подостром периоде и ремиссии болезни. Бепантен использовался в качестве монотерапии. Крем наносили на очищенные участки кожи 2 р./сут, курсом от 3-х до 6 нед. Оценку эффективности проводили по балльной системе: от 0 до 3 баллов.
0 – отсутствие симптомов;
1 – легкие проявления;
2 – умеренные проявления;
3 – выраженные проявления.
Характеристика клинических признаков атопического дерматита у наблюдаемых детей представлена в таблице 1. Средняя площадь пораженной кожи у детей колебалась от 17,7 до 43,9%. Оценка клинических симптомов на фоне применения крема Бепантен приведена в таблице 2.
В результате использования крема Бепантен было установлено значительное улучшение состояния кожи детей, страдающих атопическим дерматитом. Так, на фоне проводимой терапии существенно уменьшились гиперемия кожи, сухость, лихенификация, зуд кожных покровов. Эффективность используемого крема Бепантен отмечена у 21 (84%) обследованного ребенка, отсутствие эффекта – в 2–х случаях. Нежелательных реакций во время использования данного наружного средства не наблюдалось. Дети переносили препарат хорошо (рис. 1).
Таким образом, использование крема Бепантен в наружной терапии атопического дерматита у детей обеспечивает положительный клинический эффект в виде существенного уменьшения гиперемии, сухости, лихенификации и зуда кожи, стойкую ремиссию заболевания, предупреждает его рецидивы, благоприятно влияет на психосоматическое состояние больного ребенка и вселяет надежду на выздоровление ребенка у членов семьи. Назначение декспантенола у детей с атопическим дерматитом способствует достижению более выраженного клинического эффекта. Полученные данные позволяют рекомендовать использование крема Бепантен для ежедневного ухода за кожей, особенно при ее выраженной сухости у детей с атопическим дерматитом. Правильный уход за кожей детей, страдающих атопическим дерматитом, путем очищения и увлажнения позволяет контролировать течение болезни, увеличить продолжительность ремиссии заболевания, защитить кожу от действия вредных внешних факторов и улучшить качество жизни больного ребенка.
Источник
Статья посвящена возможностям использование декспантенола в лечении атопического дерматита у детей и взрослых. Проведена оценка эффективности применения топических средств Д-Пантенол мазь/крем у пациентов с ксерозом и зудом в период ремиссии различных дерматозов или возникших на фоне соматических заболеваний.
Актуальность
Пантотеновую кислоту (витамин В5) открыл в 1931 г. исследователь Роджер Вильямс во время изучения им факторов роста микробов. Название пантотеновой кислоты связано с широким распространением ее в природе (греческое слово «пантотен» означает «всюду») [1, 2]. После изучения ее стимулирующего эффекта на пролиферацию клеток плесени [3] в дальнейшем было синтезировано топическое средство декспантенол.
Декспантенол — стабильный спиртовой аналог пантотеновой кислоты. Топический декспантенол в виде мази впервые появился более 70 лет назад. При наружном применении декспантенол в отличие от пантотеновой кислоты быстро абсорбируется кожей и конвертируется в пантотеновую кислоту, входящую в состав кофермента А [4–6]. Коэнзим А катализирует синтез жирных кислот и сфинголипидов, входящих в состав рогового слоя кожи [7–10]. Пантотеновая кислота необходима для нормального функционирования эпителия [11]. Было доказано, что топический декспантенол работает как увлажнитель, улучшая барьерные свойства кожи, ускоряя заживление ран [10, 12–17]. Поэтому два основных показания к использованию декспантенола — это увлажнение кожи (восстановление кожного барьера) и ускорение раневого заживления.
Нарушение кожного барьера играет основную роль в развитии многих кожных заболеваний и состояний, таких как сухая кожи, чувствительная кожа, себорейный дерматит, атопический дерматит, контактный дерматит [18, 19].
Декспантенол улучшает гидратацию кожи за счет своих гигроскопических свойств и способности удерживать влагу [11, 20]. Гидратирующий эффект взаимосвязан с его способностью восстанавливать эпидермальный барьер [5]. Недавнее экспериментальное исследование влияния препарата на кожу свиней показало, что декспантенол увеличивает молекулярную подвижность липидных и белковых структур рогового слоя, тем самым создавая условия для гидратации кожи в обезвоженных участках. В частности, было продемонстрировано, что декспантенол взаимодействует с липидными структурами экстрацеллюлярных ламелл и белковыми остатками в корнеоцитах рогового слоя и за счет увеличения молекулярной подвижности компенсирует недостаточную гидратацию [21]. Механизм, за счет которого декспантенол восстанавливает и защищает кожный барьер, до конца не изучен.
Увлажнители создают условия, которые стимулируют физиологические процессы (функционирование энзимов), необходимые для сохранения или восстановления структуры кожного барьера. Топические средства пенетрируют эпидермис и встраиваются в процесс синтеза барьерных липидов и созревания корнеоцитов [20]. Можно сказать, что декспантенол стимулирует регенерацию эпидермиса, усиливая его дифференцировку и синтез липидов [19].
Лечение
Нарушения в функционировании кожного барьера приводят к увеличению трансэпидермальной потери воды и уменьшению гидратации рогового слоя, что является характерным признаком атопического дерматита (АтД) [22, 23].
Клинические исследования показали, что ежедневное использование базисных средств может предотвратить АтД и увеличить период ремиссии [24–26]. В клинических рекомендациях по ведению больных АтД Российского общества дерматовенерологов от 2015 г. эмолентам в терапии данного заболевания отводится ведущая роль: «Базовая терапия является основополагающей в ведении всех больных атопическим дерматитом и включает в себя регулярное использование смягчающих и увлажняющих средств», «Увлажняющие средства должны применяться постоянно и ежедневно, объем увлажняющих средств должен в 10 раз превышать объем используемых стероидов».
Благодаря доказанному увлажняющему и регенерирующему действию декспантенол незаменим при различных проявлениях АтД. В двойном слепом контролируемом рандомизированном исследовании с участием 60 здоровых пациентов был использован топический декспантенол в концентрации 2,5%. Ежедневное 2-кратное использование в течение 7 дней значительно улучшило гидратацию кожного барьера и уменьшило трансэпидермальную потерю воды в сравнении с группой контроля [27].
Сходные результаты получены в исследовании по изучению эффективности 2,5% декспантенола у 20 пациентов, постоянно использующих средства с лаурилсульфатом [28, 29]. Proksch и Nissen [10] показали, что крем, содержащий 5% декспантенол, восстанавливает кожный барьер и роговой слой в экспериментально поврежденной коже при ежедневном 2-кратном использовании в течение
7 дней. Biro [30] провел двойное слепое контролируемое исследование с участием 25 добровольцев с целью определения эффективности декспантенола при раздраженной коже. На предплечье пациентов наносили мазь, содержащую 5% декспантенол либо плацебо, 2 р./день в течение 26 дней. С 15-го по 22-й день на эти области также наносили 2% лаурилсульфат. Гидратация рогового слоя у пациентов, применяющих декспантенол, осталась стабильной, в то время как в группе плацебо гидратация резко упала к концу периода исследования (p<0,05). Таким образом, декспантенол показал протективное свойство за счет способности сохранять гидратацию рогового слоя даже под воздействием ирритантов.
Stettler [31] провел 2 рандомизированных сравнительных исследования топического декспантенола с участием 43 здоровых добровольцев с целью оценки влажности кожи, степени восстановления барьерной функции и эффекта, оказываемого на микрофлору кожи. Первое исследование проводили на пациентах с невоспаленной сухой и чувствительной кожей (как в стадии ремиссии при АтД). Результаты показали улучшение свойств рогового слоя, повышение влажности, увеличение длины межклеточных ламелл липидов рогового слоя (на 22-й день: 120,61 против 35,85 нм/1000 нм2 в начале исследования, p<0,001). Результаты второго исследования показали, что декспантенол не влияет на жизнеспособность бактерий-комменсалов.
Еще в одном исследовании Н. Stettler [32] изучил увлажняющий эффект декспантенола у здоровых взрослых людей с сухой кожей и у их здоровых детей. Получены данные, что эмолент повышает гидратацию рогового слоя, что отражается в увеличении электрической емкости поверхности кожи. Кроме того, декспантенол хорошо переносился детьми. При опросе пациенты с АтД подтвердили хорошую переносимость и эффективность препарата [33, 34].
Цель исследования: оценка эффективности применения топических средств (Д-Пантенол мазь/крем) у пациентов с ксерозом и зудом в период ремиссии различных дерматозов или возникших на фоне соматических заболеваний.
Материал и методы
В клинических условиях под наблюдением находились 36 пациентов (62% женщин и 38% мужчин) в возрасте от 3-х месяцев до 49 лет (медиана возраста — 23,4±14,6 года) с хроническими дерматозами в стадии ремиссии (неполной ремиссии) или соматической патологией, в клинической картине которых присутствовали ксероз и зуд. Среди причин возникновения ксероза и сопровождающего его зуда преобладал АтД (78,4%), остальная патология в общем числе занимала менее 23%: сенильный зуд (3,5%), пруриго (3,2%), псориаз (3,6%), ихтиоз (3,6%), постскабиозное состояние (2,1%), другие дерматозы (2%), соматические заболевания (2,6%), у 1% пациентов причина не была установлена.
Критерии включения:
возраст старше 2-х лет;
наличие ксероза кожи и зуда;
ремиссия (частичная ремиссия) основного кожного заболевания;
подписание информированного согласия.
Критерии невключения:
обострения воспалительных дерматозов с неконтролируемым прогрессированием вторичной инфекции (бактериальной, вирусной);
низкая комплаентность.
Пациенты в качестве монотерапии (большинство респондентов) или в составе комплексного лечения использовали крем (n=21) и мазь (n=15) Д-Пантенол (ЗАО «Фармацевтический завод Эгис», Венгрия) 2 р./день на протяжении 28 дней. Мазь назначалась при наличии очень сухой кожи у пациентов, при лифенификации, инфильтрации. Крем — при сухой, чувствительной, склонной у сухости коже. Комбинированное лечение получали 3% пациентов: топические кортикостероиды/ингибиторы кальциневрина (n=6) и системное лечение (n=5).
Эффективность оценивалась через 28 дней применения препарата с учетом динамики клинических симптомов (ксероза, зуда) по Visual Analog scale (VAS), индекса качества жизни (по двум адаптированным опросникам Дерматологического индекса качества жизни — ДИКЖ — для пациентов младше 17 лет и старше 18 лет) и анкетирования пациентов и врачей по вопросу удобства использования изучаемых топических препаратов.
Результаты и обсуждение
В начале исследования наблюдался ксероз и зуд от умеренной до тяжелой степени выраженности, средние значения индекса VAS составили 5,3±1,6 балла и 5,1±2,1 балла соответственно. У 62% находившихся под наблюдением пациентов отмечался зуд в течение 7 дней; зуд продолжительностью менее 6 часов имел место в 2/3 случаев (67%). У 82% пациентов зуд усиливался преимущественно в ночное время и/или вечером. За неделю до включения в исследование нарушение сна из-за зуда отмечалось у пациентов с медианой индекса VAS 3,5±2,3. У 95% зуд локализовался на коже лица и туловища, у 81% и 72% — на верхних и нижних конечностях соответственно.
У всех пациентов отмечалось снижение качества жизни: ДИКЖ 16±7,2 балла, при этом в группе пациентов, получавших крем Д-Пантенол, индекс был несколько выше — 19,1±6,2 балла, чем в группе получавших мазь — 14,3±7,1 балла.
Через 28 дней применения Д-Пантенола индекс VAS (зуд) снизился на 32% — с 5,2±1,8 до 3,1±0,9 балла (p<0,0001). Индекс VAS (ксероз) уменьшился на 30% — с 5,1±2,0 балла до 3,1±0,9 балла (p<0,0001) (рис. 1).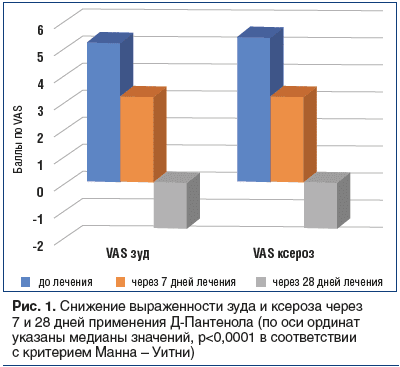
Снижение выраженности ксероза через 28 дней после применения препаратов при разных причинах возникновения сухости представлено на рисунке 2. Так, у пациентов с атопическим дерматитом индекс VAS (ксероз) снизился на 30% — до 3,7±0,3 балла (p<0,0001), при ихтиозе на 24% — до 3,0±0,4 балла (p<0,0001), при пруриго на 41% — до 2,3±0,3 балла (p<0,0004), при псориазе на 26% — до 3,8±0,3 балла (p<0,0007), при постскабиозном остоянии (при чесотке) — до 4,1±0,6 балла (p=0,2003), при сенильном зуде на 41% — до 2,3±0,6 балла (p<0,0001).
Ксероз у пациентов с системными соматическими заболеваниями снизился на 40% и составил 2,9±0,3 балла (p<0,0035).
Средние сроки статистически достоверного снижения зуда по VAS варьировали от 2 до 7 дней и зависели от основного заболевания. Так, самые короткие сроки отмечались при псориазе — 2,1±0,2 дня (p<0,001), при пруриго — 3,6±0,2 дня (p<0,002), при постскабиозном зуде — 3,9±0,3 дня (p<0,02), при АтД — 4,3±0,1 дня (p<0,001) и при ихтиозе — 4,2±0,3 дня (p<0,001). Наиболее отсроченный результат отмечался при сенильном зуде — 7,3±0,3 дня (p<0,001).
Исследовалось качество ночного сна, нарушение которого в начале исследования отмечалось у большинства пациентов (83,2%). На фоне применения Д-Пантенола вне зависимости от лекарственной формы препарата (мазь/крем) отмечалось улучшение качества ночного сна (p=0,3617), что подтверждено снижением индекса VAS (нарушение сна) в среднем на 25%: с 3,7±0,5 до 2,3±0,2 балла (p<0,0001).
Купирование зуда, улучшение качества ночного сна и устранение ксероза способствовали повышению качества жизни. В среднем по группе индекс ДИКЖ улучшился на 47%: с 13,2±0,8 до 7,7±1,8 балла (p<0,0001) (рис. 3).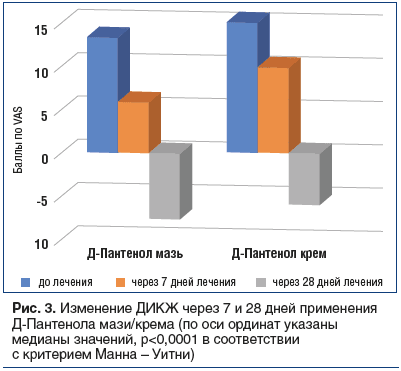
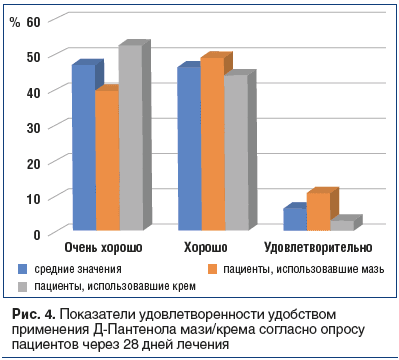
В работе исследовался еще один показатель — «удовлетворенность», который отражает мнение пациента или врача на основании сопоставления ожидаемого и полученного эффекта в сравнении с применением других препаратов, применяемых по аналогичным показаниям. Показатель «удовлетворенность», по оценке исследователей (врачей) и пациентов, по всем позициям был статистически сопоставим для мази и крема. Девять из 10 пациентов отметили хорошую и очень хорошую удовлетворенность применением Д-Пантенола мази/крема (рис. 4).
Отзывы пациентов полностью соотносятся с отзывами врачей, проводивших исследование: 9 из 10 сообщили, что удовлетворены или очень удовлетворены эффективностью Д-Пантенола независимо от формы выпуска препарата (100% для крема против 91,8% для мази) (рис. 5).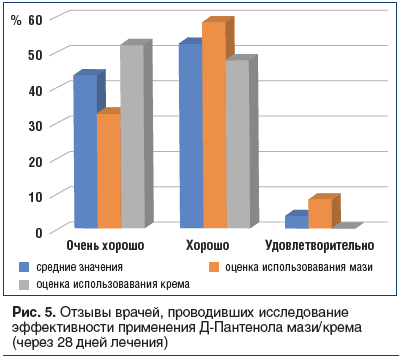
Переносимость лекарственных препаратов Д-Пантенол, по оценке исследователей (врачей) и пациентов, по всем позициям была статистически сопоставима и составила при применении мази 90,6%, при применении крема — 97,6%, включая оценку «хорошо/очень хорошо».
Выводы
Проведенное постмаркетинговое исследование эффективности применения топических средств Д-Пантенол мазь/крем в виде монотерапии или в комплексе с медикаментозным лечением показало достоверно значимое улучшение всех показателей индекса дерматологического статуса (зуд, ксероз), что свидетельствует о целесообразности их назначения данной категории пациентов.
Применение средств Д-Пантенол мазь/крем способствует устранению ксероза кожи, что подтверждается снижением индекса VAS на 40%. Купирование зуда у большинства пациентов (77%) отмечается в сроки 3–7 дней.
Применение средств Д-Пантенол мазь/крем, по оценке пациентов, высокоэффективно, способствует улучшению качества жизни, что в совокупности с удобством использования и отсутствием побочных эффектов обусловливает высокую комплаентность.
Средства Д-Пантенол мазь/крем показаны пациентам с различными заболеваниями кожи или соматической патологией, сопровождающимися зудом и ксерозом.
Источник

