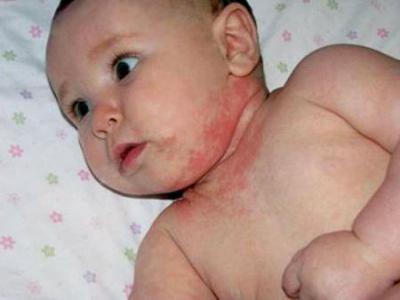
Интерлейкин 2 атопический дерматит
В статье представлены результаты исследования, посвященного определению клинико-диагностического и прогностического значение уровня IL-22 в сыворотке крови у детей с атопическим дерматитом.
Введение
Атопический дерматит (АтД) является одним из наиболее распространенных атопических заболеваний у детей, которое характеризуется неуклонно рецидивирующим течением и нередко сопровождает человека всю жизнь. Изучению патоморфогенеза и иммуногенеза данной патологии было посвящено значительное количество работ. Сложилось представление о том, что АтД может быть одним из этапов на пути атопического марша и значительную часть пациентов с отягощенной аллергологической наследственностью будет не только сопровождать на протяжении всей жизни, но и перейдет у них в бронхиальную астму [1, 2]. Остается неясным, какие именно механизмы утяжеляют течение заболевания и способствуют дальнейшей атопической трансформации.
В настоящее время сделаны попытки выявить лабораторные параметры, позволяющие прогнозировать развитие АтД и тяжесть его течения у детей с генетической предрасположенностью, однако пока еще эти лабораторные показатели не нашли широкого практического применения. Более того, прогностическая ценность таких лабораторных критериев, как уровень общего IgE и количество эозинофилов в крови, сомнительна. Как известно, ведущим фактором в патогенезе АтД у большинства больных рассматривают IgE-опосредованную гиперчувствительность. Несмотря на тесную взаимосвязь между кожей и иммунной системой, роль IgE неоднозначна, поскольку не отражает клеточный механизм развития атопии при IgE-независимой форме дерматита [3].
Принимая во внимание тот факт, что иммунологически-индуцированное воспаление кожи у детей сопровождается выбросом в кровь нейромедиаторов, нейропептидов и цитокинов, оказывающих существенное влияние на патогенез АтД [4–6], мы рассмотрели цитокины в качестве высокочувствительных маркеров атопического воспаления кожи.
В частности, интерес представляет интерлейкин-22 (IL-22), который относится к семейству цитокинов IL-10 и участвует в развитии большого числа заболеваний человека аллергического, иммуновоспалительного и аутоиммунного генеза [7, 8]. Доказана роль IL-22 в регуляции пролиферативных процессов и регенерации тканей и слизистых оболочек организма [9–11]. Биологические эффекты IL-22 осуществляются благодаря связыванию с рецептором, представляющим собой гетеродимер, состоящий из IL-22R1 и IL-10R2, который экспрессируется на эпителиальных клетках кожи. Кроме того, установлено, что лиганд-рецепторный комплекс IL-22/IL-22R играет ключевую роль в регуляции иммунных реакций [12].
Подтверждением важной роли IL-22 в патогенезе атопических процессов является тот факт, что IL-22 регулирует равновесие Th1 и Th2 клеток в сторону доминирования Th2, что приводит к развитию аутоиммунных нарушений, в частности АтД [13].
Повышенная экспрессия IL-22 является характерным признаком аллергических процессов в коже. Так, в ходе эксперимента в коже лабораторных животных после кожной сенсибилизации аллергенами пылевых клещей уровень IL-22 значительно увеличился. Показано также, что специфическое эпикутанное воздействие аллергена и повышенная экспрессия IL-22 в коже экспериментальных мышей вызвала хронический дерматит с характерным зудом и воспалением кожи, связанными с Th2-локальным и системным иммунным ответом [14].
В связи с изложенными выше фактами нами была определена цель исследования: установить клинико-диагностическое и прогностическое значение уровня IL-22 в сыворотке крови у детей с АтД.
Материал и методы
Работа выполнена на кафедре факультетской педиатрии ФГБОУ ВО Астраханский ГМУ Минздрава России и в отделении аллергологии ГБУЗ АО «ОДКБ им. Н.Н. Силищевой» (Астрахань).
Проведено открытое сравнительное проспективное рандомизированное исследование в параллельных группах. Исследование было одобрено этическим комитетом Астраханского ГМУ Минздрава России (протокол № 27 от 21.03.2016).
Нами проанализированы результаты комплексного обследования 95 детей с обострением АтД в возрасте от 1 года до 3 лет: 48 (50%) мальчиков и 47 (50%) девочек, которые находились на лечении в отделении аллергологии и иммунологии ОДКБ им. Н.Н. Силищевой. АтД легкой степени наблюдался у 22 пациентов, АтД средней степени — у 43, АтД тяжелой степени — у 30. Группу контроля составили условно здоровые дети без отягощенного семейного аллергологического и соматического анамнеза (n=20), возраст – 1–3 года. Критерии включения в исследование: АтД различной степени тяжести, период обострения, отсутствие изменений в биохимическом анализе крови, наличие информированного добровольного согласия родителей. Критерии исключения: наличие другой аллергической (бронхиальная астма, аллергический риноконъюнктивит, острая и хроническая крапивница и др.) и соматической патологии.
В ходе работы все пациенты были обследованы в соответствии с действующими Федеральными клиническими рекомендациями по диагностике и лечению АтД 2013 г., включая иммунологическое обследование (определение уровней общего и специфических IgE в сыворотке крови). В биохимическом анализе крови (уровни общего белка, глюкозы, билирубина, креатинина, мочевины, С-реактивного белка, аланинаминотрансферазы и аспартатаминотрансферазы) отклонений от нормы не выявлено.
Отягощенный семейный анамнез детей по аллергическим заболеваниям отметили 60% опрошенных мам. Вместе с тем в семьях пациентов с АтД нередко наблюдались заболевания органов желудочно-кишечного тракта (хронический гастродуоденит, хронический панкреатит и желчекаменная болезнь) — у 49, 42 и 38% соответственно.
При поступлении в стационар больные предъявляли жалобы: на зуд — 87 детей (91%), нарушение сна — 58 (61%), папулезные высыпания — 43 (45%), пустулезные высыпания — 52 (55%), сухость кожи — 95 (100%).
Уровень общего IgE в сыворотке крови был повышен у 80 (84%) детей с АтД, из них у 73 (91%) детей уровень общего IgE в сыворотке крови был выше 45 МЕ/мл в 2 раза и более. Значительное повышение уровня общего IgE было отмечено у 7 (9%) детей с тяжелым рецидивирующем течением АтД, максимальное значение — 1070 МЕ/мл у ребенка трех лет.
Помимо стандартного набора методов общеклинического обследования определяли уровень IL-22 в образцах сыворотки крови с помощью иммуноферментного анализа (ИФА) с применением наборов для количественного определения IL-22 в биологических жидкостях «Bender MedSystems Human IL-22 ELISA» (США).
Кровь для определения уровня IL-22 забирали утром натощак из локтевой вены в охлажденные силиконизированные пробирки объемом 5 мл и немедленно помещали на лед. Сыворотку выделяли путем центрифугирования со скоростью 3000 об./мин в течение 5 мин и помещали в силиконовые пробирки. Образцы замораживали и хранили при температуре -70 °C до проведения анализа. Методом ИФА определяли уровень IL-22 в образцах сыворотки крови, используя микропланшеты с сорбированными на дне лунок антителами, специфичными к IL-22 человека. IL-22 тестируемых образцов, стандартов и контрольных образцов связывался со специфическими антителами. Введенный в микропланшет биотиновый конъюгат антител к антителам IL-22 связывался с IL-22, конъюгированным с первыми антителами. После инкубации и промывки из лунок удаляли несвязавшийся биотиновый конъюгат, и в лунки вносили конъюгат — стрептавидин-пероксидазу хрена, связывающийся с биотином, конъюгированным с IL-22. После повторной инкубации и промывки из лунок удаляли несвязавшийся конъюгат стрептавидина, и в лунки вносили субстратный раствор, который взаимодействовал с ферментным комплексом с образованием окрашенного раствора.
Интенсивность окрашивания, измеренная при длине волны 450 нм, прямо пропорциональна концентрации IL-22, присутствующего в тестируемых образцах. Концентрацию IL-22 в образцах определяли по стандартной кривой, построенной по 7 приготовленным разведениям стандарта. Минимально определяемая концентрация IL-22 составила 5 пг/мл.
Статистическую обработку полученных результатов выполняли при помощи статистической программы Statistica 12.0 (StatSoft Inc., США). Анализ данных осуществляли с использованием методов вариационной статистики и непараметрических критериев. Для описания полученных количественных признаков результаты представляли в виде медианы и квартиля Me [25; 75 перцентиль]. Количественную оценку линейной зависимости между двумя случайными величинами определяли с использованием коэффициента ранговой корреляции Спирмена (RS). Критической величиной уровня значимости считали р<0,05.
Результаты исследования
В ходе исследования выявлено значимое повышение уровня IL-22 в сыворотке крови у 95 пациентов с АтД по сравнению с уровнем у практически здоровых детей: медиана 175,2 [158,9; 221,5] и 28,7 [25,6; 31,3] пг/мл соответственно (р=0,039). Статистический анализ данных показал сильную прямую корреляционную зависимость между уровнем IL-22 и индексом SCORAD (scoring of atopic dermatitis — шкала атопического дерматита): RS=0,774 (р<0,05).
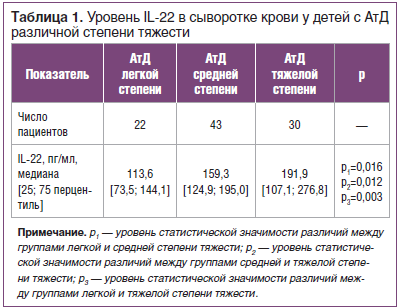
В ходе следующего этапа работы определяли уровень IL-22 в сыворотке крови у детей с АтД в зависимости от степени тяжести дерматита. Результаты показали увеличение уровня IL-22 в сыворотке крови при повышении степени тяжести АтД (табл. 1).
Причинно-следственную связь между повышением уровня IL-22 и степенью тяжести заболевания можно объяснить тем, что при АтД происходит активация Th2-локального и системного иммунного ответа, приводящая к характерному зуду и воспалению кожи. IL-22 способствует гиперплазии эпидермиса и подавляет барьерные функции кожи, усугубляя тем самым клинические проявления патологии.
Как отмечено выше, повышение уровня общего IgE в сыворотке крови отмечено у 80 детей с АтД, медиана составила 139 [72,5; 451,5] МЕ/мл, а у 15 детей обнаружены нормальные показатели общего IgE: 14,5 [8,0; 33,5] МЕ/мл, р=0,048.
Анализ концентрации IL-22 в сыворотке крови у 80 детей с АтД с гиперпродукцией IgE в сравнении с нормальным содержанием общего IgE у 15 детей с дерматитом показал, что медиана IL-22 составила 196,2 [145,1; 201,2] и 173,9 [151,4; 316,2] пг/мл соответственно (р=0,197). Статистический анализ данных показал слабую корреляционную зависимость между уровнями общего IgE и IL-22 (RS=0,307, р<0,05) при АтД. Далее мы изучили уровень IL-22 при повышенном содержании общего IgE (табл. 2).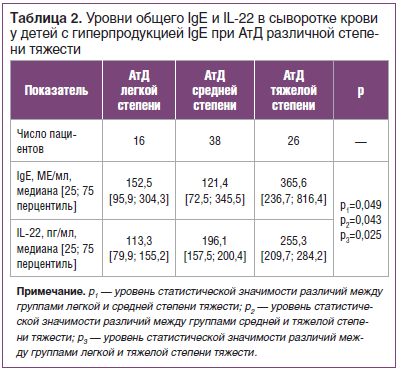
Обсуждение
Результаты исследования показали значимое повышение в 6 раз уровня IL-22 в сыворотке крови у всех детей с АтД по сравнению с уровнем IL-22 у здоровых детей. Вероятнее всего, данный факт обусловлен значительным количеством задействованных в патологическом аллергическом процессе тучных клеток, которые продуцируют IL-22. Выявлена сильная прямая корреляционная зависимость между уровнем IL-22, индексом SCORAD и степенью тяжести АтД.
Анализ данных показал слабую корреляционную зависимость между уровнями общего IgE и IL-22 при АтД у детей, но выявил связь между этими параметрами в зависимости от степени тяжести дерматита.
Результаты, полученные в исследовании, подтверждаются работой S. Mashiko et al. (2015), где установлено, что высокий уровень IL-22 коррелирует с активностью патологического процесса при атопическом и псориатическом поражении кожи [15].
Заключение
Установленные уровни IL-22 в сыворотке крови могут быть рекомендованы для прогнозирования степени тяжести АтД у детей. Повышенные уровни IL-22 в сыворотке крови определяют активность воспалительных процессов при АтД и могут рассматриваться в качестве дифференциально-диагностических и прогностических критериев для оценки степени тяжести АтД. Результаты, полученные в ходе исследования, ставят вопрос о роли IL-22 в патогенезе АтД, различных вариантов его атопической трансформации, а также коморбидной патологии.
Работа выполнена в рамках гранта конкурса «У.М.Н.И.К.-2016», договор № 11217ГУ/2016 (вн. номер 0026202) от 13.03.2017 по теме: «Разработка лечебно-косметической продукции на основе экстрактов Астраханской грязи и Гинкго билоба для детей, больных атопическим дерматитом».
Источник
Атопический дерматит (АтД) — хроническое заболевание, начинающееся в раннем детском возрасте, нередко продолжающееся в течение всей жизни и характеризующееся, как правило, стадийностью развития воспалительного процесса на коже. Заболевание сопровождается интенсивным зудом, нередко нарушающим сон и приводящим к физической и эмоциональной дезадаптации пациента и членов его семьи. АтД сопровождается симпатергической реакцией кожи (белый дермографизм) и связан с особым наследственным предрасположением к аллергии — атопией. АтД является одним из наиболее распространенных дерматозов (от 20% до 40% в структуре кожных заболеваний) и встречается во всех странах, у лиц обоего пола и в разных возрастных группах [1].
Патогенез АтД до настоящего времени во многом остается неясным, однако ведущая роль иммунных нарушений в развитии АтД не вызывает сомнений; в частности, это убедительно доказывают наблюдения за развитием АтД после пересадки костного мозга от больных с атопической предрасположенностью и у больных с тяжелыми дефектами Т-клеточного иммунитета с синдромом Вискотта–Олдрича. Так называемое «экзематозное извержение» является особенностью синдрома и диагностическим критерием для АтД, оно резко исчезает после успешного трансплантата костного мозга, что предполагает, что иммунная дисфункция непосредственно участвует в патогенезе АтД [2].
Наиболее часто иммунные нарушения у больных АтД манифестируются эозинофилией в периферической крови, повышенным содержанием в сыворотке крови IgE, увеличением популяций CD23+ моноцитов с активированными T-хелперами 2-го типа (продуцирующих ИЛ-4, ИЛ-5 и ИЛ-13); сокращением популяций CD8+ лимфоцитов с активированными T-хелперами 1-го типа (продуцирующих ИФН-γ); активированным состоянием макрофагов с активным синтезом гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ), простагландина Е, ИЛ-10; повышенным содержанием растворимых молекул клеточной адгезии (E-селектин, VCAM-1, ICAM-1), катионных белков эозинофилов; повышением спонтанного выброса гистамина базофилами [3].
Интерлейкины играют важную роль на всех стадиях реализации атопических реакций. Показано, что при АтД отмечаются иммунные нарушения регуляции функциональной активности Т-лимфоцитов. Важным звеном в патогенезе этого заболевания является сдвиг Th1/Th2-цитокинового профиля в сторону Th2-реакций [4], который сопровождается усилением секреции IgE. Показано, что ИЛ-4 и ИЛ-10 играют ключевую роль в развитии аллергического воспаления. Данные интерлейкины взаимодействуют со своими рецепторами на В-клетках и активируют синтез иммуноглобулина Е (IgE) [5, 6].
ИЛ-4 синтезируется СD4 и CD8 Т-лимфоцитами, тучными клетками и эозинофилами [7]. Считается, что ИЛ-4 играет важную роль в инициации иммунного ответа; выполняя роль медиатора дифференцировки предшественников Т-хелперов в Th2, предотвращая апоптоз Th2-лимфоцитов, он способствует поддержанию аллергического иммунного ответа [8]. ИЛ-4 ограничивает синтез макрофагами провоспалительных ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12, ФНО-α. ИЛ-4 служит кофактором пролиферации неактивных В-лимфоцитов, а также индуцирует в этих клетках синтез IgE и IgG4. Дисрегуляция секреции ИЛ-4 является ключевой в развитии аллергической патологии. Увеличение синтеза IgE в ответ на стимуляцию ИЛ-4 приводит к усилению IgE-стимулированного синтеза цитокинов тучными клетками, способными вырабатывать ИЛ-4 и ИЛ-6. Кроме того, ИЛ-4 стимулирует экспрессию сосудистых молекул адгезии-1, увеличение концентрации которых происходит на поверхности эндотелиальных клеток вследствие воспалительного процесса. Сосудистые молекулы адгезии-1 обеспечивают миграцию эозинофилов и моноцитов в очаг воспаления, т. е. клеточную инфильтрацию, характерную для развития последней фазы атопической реакции. При наличии островоспалительных изменений в участках кожного поражения определялось повышение продукции ИЛ-4 [9].
ИЛ-10, продуцируемый Th2, может рассматриваться как антагонист ряда цитокинов. ИЛ-10 подавляет продукцию ИФН-g Th1-цитокинового профиля; также он тормозит пролиферативный ответ Т-клеток на антигены, подавляет секрецию активированными моноцитами ИЛ-1В, ИЛ-6 и ФНО. ИЛ-10 стимулируют секрецию иммуноглобулинов B-клетками, также ИЛ-10 может стимулировать синтез IgE. Основной функцией ИЛ-10 является защита тканей от повреждения при воспалении. Этот интерлейкин обладает иммунорегуляторными свойствами и относится к числу противовоспалительных; он подавляет секрецию цитокинов Т-хелперами 1-го типа, контролируя таким образом балансTh1/Th2 и осуществляя регуляцию воспалительного ответа по принципу отрицательной обратной связи [10]. ИЛ-10 подавляет функции антиген-презентирующих клеток, а также продукцию провоспалительных цитокинов, в том числе ИЛ-1, способствуя уменьшению таких симптомов АтД, как выраженный зуд, инфильтрация и гиперемия [11]. В своем ингибирующем действии на клеточный иммунитет ИЛ-10 синергичен с ИЛ-4. У больных АтД с повышенным уровнем ИЛ-10 в коже отмечается ослабление противоинфекционной защиты вследствие снижения содержания антимикробных пептидов [12], что, следовательно, повышает риск развития инфекционных осложнений на коже больных АтД.
Основные принципы терапии АтД
Выбор терапии в каждом случае зависит от вида, тяжести и продолжительности АтД. Однако, с учетом иммунологических механизмов развития АтД, особый интерес представляют методы лечения, которые могут корректировать иммунные нарушения. Разными исследователями давно предпринимаются попытки связать возникновение и развитие иммунозависимых дерматозов с изменениями сывороточных уровней цитокинов. На основе полученных знаний продолжаются попытки разработать новые фармацевтические лекарственные средства. Современным методом лечения тяжелых дерматозов является применение препаратов, полученных с помощью биотехнологических технологий, так называемых биологических препаратов, на фоне постоянного применения которых наступает и сохраняется выраженное клиническое улучшение или ремиссия [13]. Например, одним из таких препаратов является инфликсимаб, который активно используется для лечения псориаза. Механизм действия препарата заключается во влиянии на цитокиновый профиль Th1-типа, связанный с повышением уровня ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-7, ИЛ-8, ИФН-γ и ФНО-α [14]. В настоящее время предпринимаются подобные попытки применения иммунотропных препаратов и при лечении АтД, например Циклоспорина А, который селективно ингибирует экспрессию генов, участвующих в ранних этапах активации Т-лимфоцитов, в результате чего Т-лимфоцит прекращает синтезировать цитокины, не происходит пролиферации клеток и подавляется иммунное воспаление. Из-за снижения числа активных Т-лимфоцитов, которые экспрессируют рецепторы для ИЛ-2, подавляется продукция таких цитокинов, как ИЛ-3, ИЛ-4 и ИЛ-5. Однако препарат обладает рядом побочных эффектов, вследствие которых лечение им проводится только больным с рефрактерным течением болезни под строгим наблюдением специалистов [15].
Также давно известно, при АтД отмечается тенденция к улучшению в летнее время и ухудшению зимой. Еще в начале 20-х гг. прошлого века было показано, что морской климат положительно влияет на течение АтД, а в 1948 г. были изучены положительные эффекты ультрафиолетового излучения [16]. Научные достижения в фотоиммунологии и молекулярной биологии позволили объяснить механизм действия фототерапии: она воздействует на воспалительные клетки, такие как нейтрофилы, эозинофилы, макрофаги, клетки Лангерганса, изменяет продукцию цитокинов и обладает выраженным антибактериальным эффектом [17]. В частности, известно, что фототерапия лучами УФ-спектра, применяемая для лечения больных со среднетяжелыми и тяжелыми формами течения АтД, способна оказывать нормализующее влияние на их иммунный статус. Установлено, что терапия низкими (5–20 Дж/см2) и средними (30–40 Дж/см2) дозами ультрафиолетового излучения УФА-1-диапазона с длиной волны 350–400 нм приводит к существенному снижению содержания CD4+ лимфоцитов и ИФН-γ в очагах поражения кожи, что свидетельствует об иммуносупрессивном действии УФА-1-излучения [18]. Показано, что фототерапия с применением средневолнового ультрафиолетового излучения 311 нм (УФБ 311 нм) у больных псориазом приводила к достоверному снижению изначально повышенных уровней провоспалительных и регуляторных цитокинов ИЛ-1, ФНО-α, ИЛ-2 и ИФН-γ, а также к повышению изначально сниженного уровня противовоспалительного цитокина ИЛ-4, что коррелировало с положительным клиническим эффектом [19]. Однако в доступной литературе не выявлено сведений о влиянии УФ-терапии на уровни ИЛ-4 и ИЛ-10 у больных АтД.
В настоящее время сведения о существенной роли ИЛ-4 и ИЛ-10 у пациентов с АтД в отечественной литературе недостаточны. Также немногочисленны данные о влиянии фототерапии УФБ 311 нм на сывороточные уровни ИЛ-4 и ИЛ-10 у больных АтД.
Целью данного исследования было изучить взаимосвязь клинических проявлений и течения кожного процесса у больных АтД с сывороточными уровнями ИЛ-4 и ИЛ-10; изучить динамику сывороточных концентраций ИЛ-4, ИЛ-10 у больных АтД на фоне проведения стандартной медикаментозной терапии в сочетании с УФ-терапией и оценить корреляцию эффективности терапии с уровнями изучаемых интерлейкинов.
Материалы и методы исследования
В исследование были включены 35 больных АтД — 19 женщин и 16 мужчин в возрасте от 17 до 57 лет. Степень тяжести АтД устанавливалась в соответствии с клиническими критериями — «scoringatopicdermatitis» (SCORAD). У всех пациентов, включенных в исследование, диагностировано среднетяжелое течение АтД, они находились на стационарном лечении и получали стандартную терапию, адекватную обострению АтД, согласно Федеральным клиническим рекомендациям по ведению больных с атопическим дерматитом от 2015 г. [1], в том числе пациенты получали антигистаминные препараты — хифенадин 25 мг по 1 таблетке 2 раза в день — 14 дней, курс фототерапии по методике УФБ 311 нм ежедневно, всего 12 процедур на курс лечения; наружное лечение включало топические глюкокортикостероидные препараты — крем аклометазон и мазь мометазон.
Контрольную группу составили 11 практически здоровых добровольцев (без АтД), 5 мужчин и 6 женщин в возрасте от 25 до 40 лет.
Проводилось иммунологическое исследование: определение концентраций сывороточных уровней ИЛ-4 и ИЛ-10 методом ELISA на аппарате MULTISKANGO (ThermoFisherScientific, США) с помощью тест-систем производства «Вектор-Бест» (Россия). Исследование в основной группе наблюдения проводилось дважды: при поступлении в стационар в период обострения заболевания и после проведения курса фототерапии, в контрольной группе — однократно.
Полученные результаты и их обсуждение
В результате проведенного лечения к окончанию курса терапии клиническое излечение констатировано у 5 больных АтД, значительное улучшение — у 24 больных, незначительное улучшение — у 5 больных; эффект от лечения отсутствовал у 1 больного.
Результаты оценки содержания исследованных интерлейкинов в образцах сыворотки крови представлены в табл. 1 и 2.
Таким образом, в результате исследования показано, что у больных АтД на фоне обострения заболевания отмечается умеренное повышение сывороточной концентрации ИЛ-10; после проведенной фототерапии у пациентов с АтД уровни ИЛ-10 также значимо превышали сывороточные показатели у здоровых доноров на 9,7% (табл. 1). В отношении уровней ИЛ-4 статистически значимых различий до и после лечения выявлено не было (табл. 2).
Заключение
Сывороточные уровни ИЛ-4 у больных АтД существенно не отличались от таковых у здоровых доноров; также существенно не изменились они на фоне проведенного лечения с включением курса фототерапии УФБ 311 нм и достигнутой клинической ремиссии — следовательно, можно предположить, что роль данного цитокина в иммунопатогенезе АтД не является ведущей и дальнейшие поиски новых терапевтических подходов к данному заболеванию следует вести в иных направлениях. В то же время анализ сывороточных уровней ИЛ-10 у пациентов с АтД показал их повышение примерно на 19,4% по сравнению с таковыми у здоровых добровольцев в контрольной группе — это свидетельствует о значимости данного интерлейкина в механизмах регуляции иммунопатологических состояний, приводящих к развитию АтД. Следовательно, объединенные усилия дерматологов, иммунологов и специалистов других фундаментальных и клинических специальностей следует направить на поиск возможности влияния на данный патогенетический фактор.
Литература
- Прошутинская Д. В., Чикин В. В., Знаменская Л. Ф. и др. Федеральные клинические рекомендации по ведению больных атопическим дерматитом. 2015. [Электронный ресурс]. Режим доступа: https://www.cnikvi.ru/docs/clinic_recs/bolezni-kozhi-i-pridatkovkozhi/atopicheskiy_dermatit.
- Saurat J.-H. Eczema in primary immune-defficiencies: clues to the pathogenesis of atopic dermatitis with special reference to the Wiskott-Aedrich syndrome // Acta Derm Venerol. 1985; Vol. 114: 125–128.
- Сергеев А. Ю., Караулов А. В., Сергеев Ю. В. Иммунологические основы патогенеза главных воспалительных дерматозов человека // Иммунопатология, аллергология, инфектология. 2003. № 3. С. 10–23.
- Саликова Т. И. с соавт. Мутации в гене филаггрина как предрасполагающий фактор развития атопического дерматита // Клиническая дерматология и венерология. 2010. № 3. С. 4–7.
- Яриллин А. А. Основы иммунологии. М.: Медицина, 1999. 608 с.
- Гималова Г. Ф., Карунас А. С., Хуснутдинова Э. К. Молекулярно-генетические аспекты атопического дерматита // Медицинская генетика. 2012. № 12. 19 с.
- Балаболкин И. И., Тюменцева Е. С. Влияние генетических факторов на развитие атопического дерматита у детей // Педиатрия. 2009 Т. 27. № 2. С. 125–129.
- Виноградова Т. В. и соавт. Современная оценка цитокинового статуса детей при атопическом дерматите // Российский вестник перинатологии и педиатрии. 2014. № 1.
- Чебуркин А. А., Смолкин Ю. С. Профилактика атопического дерматита // Аллергология и иммунология в педиатрии. 2004. № 1. С. 59.
- Чистова И. Я. Роль атопии в формировании профессиональных аллергодерматозов. Автореф. дис. … к.м.н.: 14.02.2004. М., 2013. 17 с.
- Петрищева И. В., Цибиков Н. Н., Фефелова Е. В. Динамика интерлейкинов при атопическом дерматите в период обострения и ремиссии // ЭНИ Забайкальский медицинский вестник. 2014. № 4. С. 101–104.
- Ong P. Y., Ohtake T., Brandt C. et al. Endogenous antimicrobial peptides and skin infections in atopic dermatitis // N. Engl. J. Med. 2002. Vol. 34. P. 1151–1160.
- Кубанов А. А., Матушевская Ю. И. Опыт применения препарата Инфликсимаб в лечении больных тяжелыми формами псориаза // В помощь практикующему врачу. 2008. № 6. С. 75–80.
- Кочергин Н. Г., Смирнова Л. М., Айрапетян Н. Р. Инфликсимаб в терапии псориаза // В помощь практикующему врачу. 2005. № 5. С. 37–39.
- Кудрявцева А. В. Циклоспорин А при атопическом дерматите у детей: мифы и реальность терапии тяжелых форм заболевания // Вопросы практической педиатрии. 2015. Т. 11. № 4. С. 85–90.
- Nexman P. N. Clinical Studie’s of Besnier’s Prurigo. Dissertation. Copenhagen: Rosenkide and Bagger, 1948.
- Grundmann S. A., Beissert S. Modern aspects of phototherapy for atopic dermatitis // J Allergy (Cario). 2012; 2012: 1211797.
- Авиденко И. Н., Кубанов А. А. Эффективность дальней длинноволновой ультрафиолетовой терапии у больных атопическим дерматитом // Вестник дерматологии и венерологии. 2009. № 3. С. 61–63.
- Талыбова А. М. Ближайшие и отдаленные результаты фототерапии средневолновым ультрафиолетовым излучением 311 нм с учетом изучения иммунного статуса и морфофункционального состояния кожи больных псориазом. Автореф. дис. … к.м.н.14.02.2010. М., 2011. 17 с.
И. В. Кошелева1, доктор медицинских наук, профессор
А. Р. Хасанова
ГБОУ ДПО РМАНПО МЗ РФ, Москва
1 Контактная информация: irina@msk.org.ru
Современные терапевтические подходы к атопическому дерматиту: роль фототерапии и поиск новых путей/ И. В. Кошелева, А. Р. Хасанова
Для цитирования: Лечащий врач № 4/2018; Номера страниц в выпуске: 24-26
Теги: кожа, хроническое заболевание, дерматоз, аллергия
Купить номер с этой статьей в pdf
Источник
Notice: Trying to access array offset on value of type bool in /var/www/www-root2/data/www/adm-bizhbulyak.ru/wp-content/themes/arianna/library/core.php on line 498