Максилак при аллергическом дерматите

Статья посвящена эффективности синбиотиков у детей с атопическим дерматитом. Рассмотрены новые возможности применения синбиотика Максилак® Бэби у детей с атопическим дерматитом
Введение
Атопический дерматит (АД) у детей занимает первое место среди патологий, связанных с пищевой аллергией, а его частота составляет от 15,6 до 35% [1, 2]. АД характеризуется непрерывно рецидивирующим течением, резистентностью к терапии, развитием вторичных осложнений, снижением качества жизни [3, 4]. Эффект от традиционной терапии АД оказывается не всегда достаточно выраженным, часто заболевание имеет волнообразное течение, что придает вопросам выбора рациональной терапии данной формы аллергии особую актуальность. Работы зарубежных и отечественных исследователей последних лет показали, что аллергические проявления являются результатом сложных взаимодействий между генетическими, эпигенетическими, экологическими факторами и микробным воздействием на ранних этапах жизни ребенка [5–7]. Дисбиоз играет ключевую роль в патогенезе АД и предшествует появлению клинических симптомов заболевания, а восстановление кишечной микробиоты служит предупреждению и лечению данной патологии [8, 9] и защите от проявлений атопии [10–13]. В профилактике и лечении АД хорошую эффективность показали синбиотики, представляющие собой комбинацию полезных бактерий (пробиотиков) и субстрата для их размножения (пребиотиков). Так, метаанализ продемонстрировал доказательства полезности применения синбиотиков для лечения АД у детей в возрасте 1 года и старше, особенно в случае использования комбинации пробиотических штаммов [14]. К инновационным синбиотикам последнего поколения относится
Максилак® Бэби, выпускаемый в форме лиофилизата в гранулах, специально для детей с 4-месячного возраста. Он содержит 9 специально подобранных штаммов полезных бактерий, в т. ч. Lactobacillus rhamnosus GG и Bifidobacterium longum BG-7 в концентрации 1 млрд КОЕ + пребиотический компонент — фруктоолигосахариды. Гранулы Максилак® Бэби защищены технологией Micro MURE® (Multi Resistant Encapsulation) двумя оболочками: белковой и из коллоидных полисахаридов. Белковая оболочка позволяет без потери качественного и количественного состава пройти три естественных барьера: кислую среду желудка, соли желчных кислот, пищеварительные ферменты. Оболочка из коллоидных полисахаридов защищает содержимое от воздействия влаги и высоких температур.
Максилак® Бэби не содержит лактозы и казеина, что особенно важно для детей с АД, имеющих сенсибилизацию к белкам коровьего молока. Исходя из вышеизложенного определена цель исследования: совершенствовать методы лечения АД, изучив эффективность синбиотика Максилак® Бэби у детей первых лет жизни в составе комплексной терапии.
Материал и методы
Под наблюдением находились 65 детей с АД в возрасте от 4-х мес. до 2-х лет с младенческой формой заболевания. Из них детей до 1 года — 64,6%, от 1 года до 2-х лет — 35,4%, мальчиков — 50,7%, девочек — 49,3%. У всех детей имела место сенсибилизация к пищевым аллергенам. Среднетяжелое течение заболевания отмечалось у 58,4% пациентов, легкое — у 41,6%. Экссудативная форма диагностирована у 63,1% детей, эритематозно-сквамозная — у 27,7%, лихенификация — у 9,2%. Всем пациентам проводилось углубленное клиническое обследование с оценкой тяжести течения по шкале SCORAD (scoring of atopic dermatitis — шкала атопического дерматита) в баллах. При среднетяжелом течении заболевания индекс SCORAD составил 15–40 баллов, при тяжелом — более 40, при легком — до 15 баллов. Назначались лабораторно-инструментальные исследования (общий анализ крови, общий анализ мочи, кал на яйца глистов и простейшие, кал на дисбактериоз, УЗИ органов брюшной полости) и специфические аллергологические: сбор аллергологического анамнеза, определение общего IgE и аллерген-специфических IgE к пищевым аллергенам (Food Panel).
Наблюдаемые пациенты были разделены на 2 группы. В основную группу вошли 35 детей от 4-х мес. до 3-х лет с АД, получающих в составе комплексной терапии (гипоаллергенная диета, наружные противовоспалительные средства, лечебно-косметический уход за кожей и антигистаминные препараты) синбиотик Максилак® Бэби по 1 пакетику-саше в сутки в течение 20 дней. Группу сравнения составили 30 детей с АД, получающих только комплексную противоаллергическую терапию, которая в сравниваемых группах не различалась. Обе группы были сопоставимы по возрасту, полу, клиническим формам заболевания и тяжести течения.
Клиническую эффективность синбиотика Максилак® Бэби в комплексном лечении АД у детей оценивали по индивидуальному терапевтическому эффекту (ИТЭ) и общему терапевтическогму эффекту. ИТЭ оценивался по срокам наступления ремиссии и снижению индекса SCORAD в динамике. Высоким ИТЭ считался при наступлении ремиссии через 9–10 дней, снижении индекса SCORAD в 3 раза и более; средним — соответственно через 12–14 дней и в 2,0–2,9 раза. Низким ИТЭ считался при наступлении ремиссии через 15 дней и снижении индекса SCORAD менее чем в 2 раза. Общий терапевтический эффект оценивали по проценту больных, продемонстрировавших положительный ИТЭ. Также учитывали и долгосрочные результаты проводимой терапии, которые оценивали по удлинению периода ремиссии, снижению уровня сенсибилизации и по нормализации показателей со стороны микрофлоры кишечника. Статистическую обработку материала проводили с использованием методов вариационной статистики с помощью пакета программ Statistica 6.0.
Результаты и обсуждение
Анализ данных показал, что на фоне использования синбиотика Максилак® Бэби в составе комплексного лечения АД у детей основной группы общий терапевтический эффект составил 91,4±5,1%, а в группе сравнения — 80,0±4,3%, р<0,05. В основной группе со 2–3-го дня от начала лечения отмечалась значительная положительная динамика со стороны кожного процесса: уменьшение площади поражения более чем 2 раза, снижение интенсивности кожного зуда и улучшение качества сна. Полное восстановление ночного сна у 80% пациентов отмечалось к 5–6-му дню от начала терапии. У 82,8% пациентов основной группы в среднем через 9,1±2,3 дня отмечалось полное исчезновение воспалительных элементов на коже: гиперемии, лихенификации, расчесов, высыпаний, шелушения и мокнутия, а у части детей из всех симптомов сохранялась только сухость кожи. В группе сравнения у 76,6% детей клиническая ремиссия достигнута в среднем через 13,8±1,4 дня, р<0,05.
В группе получающих синбиотик Максилак® Бэби в составе комплексной терапии высокий ИТЭ отмечался в 60,0% случаев, а в группе сравнения — только в 30% (рис. 1). Таким образом, высокий ИТЭ в основной группе отмечался в 2 раза чаще, а низкий — 2,3 раза реже, чем в группе сравнения.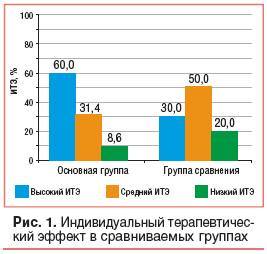
В основной группе после проводимой терапии индекс SCORAD снизился в среднем в 5 раз — с 29,0±4,8 до 5,6 ±1,8 балла, тогда как в группе сравнения только в 3 раза — с 29,3±4,7 до 9,8±1,9 балла, р<0,05 (рис. 2).
По данным аллергологического обследования (табл. 1) установлено, что
у детей основной группы в 85,7% случаев отмечался повышенный уровень общего IgE в сыворотке крови, а его средние значения после лечения снизились в 3,7 раза. В группе сравнения повышенный уровень общего IgE в сыворотке крови отмечался в 86,6% случаев, а его уровень после лечения уменьшился только в 2,5 раза. У детей основной группы отмечалось повышение в сыворотке крови специфических IgE к белкам коровьего молока в 77,1% случаев, а в группе сравнения — в 76,6%. Показатели аллерген-специфических IgE у детей основной группы через 3 мес. после проведенного лечения свидетельствовали о том, что уровень сенсибилизации к белкам коровьего молока уменьшился более чем на 1 класс (значения показателей уменьшились с очень высокого уровня ++++ до среднего ++, с высокого +++ до низкого +), р<0,05. В группе сравнения темпы снижения специфических IgE в процессе лечения были ниже, и в итоге их уровень снизился на 1 класс и менее (с очень высокого уровня ++++ до высокого, с высокого +++ до среднего, со среднего ++ до низкого +), р<0,05.
В основной группе на фоне купирования кожного процесса отмечалось увеличение количества бифидобактерий с 107–108 до 109–1010 КОЕ на 1 г фекалий, лактобактерий — с 105 до 106–107 КОЕ на 1 г фекалий и уменьшение содержания условно-патогенных микроорганизмов (гемолитических, лактозонегативных кишечных палочек, энтерококков и др.).
Изучение долгосрочных клинических результатов в течение 12 мес. показало, что средняя продолжительность ремиссии у детей основной группы увеличилась в 3 раза — с 3-х до 9 мес., а в группе сравнения — только в 2 раза, с 3-х до 6 мес. Обострения после проведенного лечения характеризовались более низкой интенсивностью клинических проявлений со стороны кожного процесса, уменьшением зуда, воспалительных проявлений и сокращением площади высыпаний. За время наблюдения у 62,8% детей основной группы и только у 43,3% группы сравнения отмечались стойкая клиническая ремиссия и отсутствие обострений АД.
Переносимость синбиотика Максилак® Бэби у детей грудного и раннего возраста на протяжении всего курса лечения оценивалась как отличная и хорошая. Побочных эффектов не зарегистрировано.
Выявленные положительные краткосрочные и долгосрочные результаты применения синбиотика Максилак® Бэби в составе комплексной терапии АД, вероятно, обусловлены входящими в их состав пробиотическими бактериями и пребиотиком олигофруктозой, что способствует улучшению пищеварения, подавлению роста патогенной микрофлоры и нормализации микробиоты кишечника, а также восстановлению нормальной функции слизистой оболочки, которая, формируя биопленку, снижает проницаемость тканевых барьеров для токсических продуктов. Нормальная микрофлора кишечника обеспечивает правильное переваривание пищи, эффективное всасывание питательных веществ и витаминов, стимулирует местный иммунитет, предупреждает развитие дисбиоза и аллергии. С одной стороны, пробиотические бактерии, входящие в состав синбиотика, вырабатывают протеолитические ферменты, которые гидролизуют белок молока (это устраняет сенсибилизирующий фактор и, кроме этого, компенсирует ферментативную недостаточность в случае пищевой непереносимости), с другой стороны, способствуют снижению аллергического воспаления, воздействуя на цитокиновый профиль, и восстанавливают барьерную функцию кишечника.
Заключение
Таким образом, включение в состав комплексной терапии АД у детей синбиотика Максилак® Бэби показало общую терапевтическую эффективность в 91,4% случаев, что проявилось сокращением периода обострения в 1,5 раза, высоким индивидуальным терапевтическим эффектом в 60% случаев, снижением индекса SCORAD в 5 раз. Долгосрочные позитивные эффекты характеризовались продлением ремиссии со стороны кожного процесса в 3 раза, а у 62,8% больных отмечалась стойкая клиническая ремиссия за время наблюдения. Клиническая эффективность проводимой терапии отмечалась на фоне уменьшения уровня общего IgE в 3 раза и аллергенспецифических IgE более чем на 1 класс, а также нормализации кишечной микробиоты. Полученные результаты открывают большой потенциал синбиотика Максилак® Бэби в лечении детей с АД.
Источник

Общие аспекты и механизмы действия пробиотиков при атопии
Согласно одной из гипотез, причиной столь широкого возникновения атопических заболеваний, таких как атопический дерматит и бронхиальная астма являются качественные и количественные изменения кишечной микрофлоры. Так у лиц, страдающих данными заболеваниями, было обнаружено повышенное содержание клостридий и сниженное содержание бифидобактерий в стуле [66, 67, 68].
Показано, что применение лакто- и бифидобактерий может стимулировать противовоспалительный и противоаллергический ответ, что, предположительно, обусловлено их способностью компенсировать нарушения состава микрофлоры и нормализовать проницаемость кишечной стенки [69, 70]. Не исключено, что возможные механизмы действия пробиотиков включают конкурентное микробное взаимодействие, продукцию антибактериальных метаболитов, изменение состояния слизистой кишечника и модуляцию иммунного ответа [71]. Согласно другой гипотезе, пробиотики усиливают специфический IgA-ответ и снижают выработку цитокинов, связанных с аллергическим воспалением [68].
Существует ряд клинических исследований, посвященных оценке профилактического и лечебного эффекта пробиотиков при атопических заболеваниях, проведенных в последние годы, и уже выполнены мета-анализы применения пробиотиков при данной нозологической форме.
Профилактика атопического дерматита / экземы
Профилактика атопической экземы
В рандомизированном контролируемом исследовании 159 беременных женщин с атопией в анамнезе (атопическая экзема, ринит, бронхиальная астма у пациентки, ее ближайших родственников или мужа) получали L. rhamnosus GG или плацебо в течение 2-4 недель до родов [72]. В последующие 6 месяцев при естественном вскармливании кормящие грудью матери или (при искусственном вскармливании) непосредственно дети продолжали получать L. rhamnosus GG или плацебо. Первичным конечным критерием оценки в рамках исследования была частота возникновения хронической рецидивирующей атопической экземы у ребенка (период последующего наблюдения — 2 и 4 года). При обследовании детей в возрасте 2 лет частота возникновения атопической экземы составляла 23% у детей, получавших пробиотик по сравнению с 46% в группе плацебо (относительный риск 0,51, р=0,0008). Относительный риск возникновения атопической экземы при применении пробиотиков составил 0,51, а число пациентов, которое необходимо пролечить пробиотиком для предотвращения 1 случая атопической экземы — 4,5. Аналогичная тенденция отмечалась и при повторном обследовании детей через 4 года от момента начала исследования (частота возникновения атопической экземы 26% и 46%, соответственно). Относительный риск возникновения атопической экземы через 4 года практически не изменился и составил 0,57, а частота положительных кожных скарификационных проб на пищевые аллергены не отличалась между группами (20% в группе лечения пробиотиком и 18% — в контрольной группе). Последний факт свидетельствует о том, что использование пробиотиков не уменьшает выраженность сенсибилизации организма к пищевым аллергенам, а способствует тому, что сенсибилизация не проявляется клинически [72].
Еще в одном двойном слепом плацебо контролируемом исследовании, в котором приняли участие 62 пары (матери и дети с высоким риском возникновения атопии), также было показано, что назначение пробиотиков L. rhamnosus GGи B. lactis Вb-12 женщинам во время беременности и кормления грудью значительно снижает риск возникновения у ребенка атопической экземы в течение первых 2 лет жизни по сравнению с плацебо (15% и 47%, соответственно; относительный риск 0,32, р=0,0098). Интересным является тот факт, что наиболее выраженный эффект от применения пробиотиков у матерей отмечался у детей с повышенным уровнем IgEв пуповинной крови. При этом у матерей, получавших пробиотики во время беременности и лактации, отмечалось увеличение уровня противовоспалительного цитокина — трансформирующего фактора роста b2 (TGF-b2) в молоке [73].
Важно отметить, что применение пробиотиков при беременности и грудном вскармливании в качестве профилактики развития атопии включено в «Рекомендации по ведению пациентов с атопическим дерматитом», разработанныеАмериканской академией дерматологии, и имеет самый высокий уровень доказательности — I[74].
В 2012 г. был опубликован мета-анализ рандомизированных контролируемых исследований в котором устанавливалось, действительно ли применение пробиотиков во время беременности и в раннем детском возрасте снижает частоту возникновения атопического дерматита и IgE-ассоциированных форм атопического дерматита у детей первых лет жизни [75]. Оцениваемое вмешательство включало применение в качества пищевой добавки пробиотиков по сравнению с плацебо. Первичным оцениваемым параметром была частота развития у ребёнка атопического дерматита и IgE-ассоциированных форм атопического дерматита. Всего было идентифицировано 18 публикаций на основании 14 исследований. Мета-анализ продемонстрировал, что применение пробиотиков снижает частоту атопического дерматита (относительный риск 0,79). Относительный риск развития IgE-ассоциированных форм атопического дерматита составил 0,8 (95% ДИ 0,66-0,96). Таким образом, при проведении мета-анализа были получены доказательства умеренной роли пробиотиков в профилактике развития атопического дерматита и IgE-ассоциированных форм атопического дерматита у детей первых лет жизни. Благоприятный эффект от применения пробиотиков не зависел от времени применения пробиотиков (использование матерью во время беременность или назначения ребёнку первых месяцев жизни) и от того, кому назначались пробиотики (матери во время беременности и/или кормления грудью, ребёнку или обоим) [75].
В 2013 г. в журнале JAMA Dermatology были опубликованы результаты мета-анализа, в ходе которого изучалось влиянияе пищевых добавок (пробиотиков, пребиотиков, молочной смеси или жирных кислот) на профилактику развития атопического дерматита или на уменьшение его тяжести у детей в возрасте до 3 лет [76]. Из 91 статьи 21 публикация соответствовала критериям включения в систематический обзор. Всего 6859 участников (дети и матери, которые были беременны или кормили детей грудью) в 21 исследованияхполучали добавки к пище. В качестве контрольной группы рассматривалось 4134 ребёнка и/или матерей. Как оказалось, пищевые добавки являются эффективным методом профилактики атопического дерматита (польза продемонстрирована в 11 из 17 исследований) или уменьшении тяжести заболевания (5 из 6 исследований). Наилучшим эффектом обладали пробиотики, назначаемые матерям и детям, как для профилактики, так и для лечения атопического дерматита. Так, пробиотик Lactobacillus rhamnosus GG наиболее эффективен в долговременной профилактике развития атопического дерматита. Противоречивые результаты были получены различными исследовательскими группами, которые изучали влияние молочной смеси, обогащённой аминокислотами, на профилактику и течение атопического дерматита. Таким образом, определённые пищевые добавки можно рассматривать как оказывающие положительное влияние на профилактику возникновения или течение (уменьшение тяжести) атопического дерматита у детей младшего возраста [76].
Лечение атопической экземы
В плацебо контролируемом исследовании по оценке эффективности применения L. rhamnosus GG у детей с атопической экземой и аллергией на коровье молоко принял участие 31 ребенок в возрасте от 2,5 до 15,7 месяцев. Все дети получали питательную молочную смесь на основе высокогидролизированной сыворотки с добавлением или без добавления L. rhamnosus GG в течение 1 месяца. Тяжестьзаболеванияоцениваласьпошкале SCORAD (Scoring of Atopic Dermatitis Severity Index). При оценке через 1 месяц было отмечено значительное снижение суммы баллов у детей, получавших пробиотик (с 26 до 15 баллов, р=0,008) по сравнению с группой плацебо (с 21 до 19 баллов, р=0,89) [70].
Во втором рандомизированном двойном слепом плацебо контролируемом исследовании 27 детей (средний возраст 4,6 месяца) с атопической экземой, находившихся на грудном вскармливании, были переведены на искусственное вскармливание с молочной смесью на основе высокогидролизированной сыворотки с или без добавления одного из двух штаммов пробиотиков: L. rhamnosus GG (ATCC 53103) или B. lactis BB-12 в течение 6 месяцев. Основными оцениваемыми критериями были распространенность, тяжесть и субъективные симптомы (зуд и нарушение сна) атопической экземы, оцениваемые с помощью шкалы SCORAD. Спустя 2 месяца балльная оценка тяжести атопического дерматита по шкале SCORADуменьшилась в обеих лечебных группах по сравнению с контрольной группой (р=0,002). Так, оценка по шкале составляла 16 баллов перед началом исследования, и уменьшилась в группе B. lactis BB-12 до 0 и в группе L. rhamnosus GG до 1, по сравнению с 13,4 баллами в контрольной группе [77].
В последнем исследовании с аналогичным дизайном 230 детей с клиникой атопического дерматита или атопической экземой и предполагаемой непереносимостью коровьего молока получали либо L. rhamnosus
GG либо плацебо в течение 4 недель. Через 4 недели после окончания исследования у 120 детей была проведена двойная слепая плацебо контролируемая проба на переносимость коровьего молока. Как оказалось, не было отмечено статистически значимых различий в изменении оценки по шкале SCORAD между исследуемыми группами непосредственно после окончания лечение и через 4 недели. Однако, у детей, сенсибилизированных к белку коровьего молока (наличие специфических IgE), применение лактобактерий привело к более выраженному снижению оценки по шкале SCORAD, чем в группе плацебо (-26,1 vs -19,8, р=0,036), от исходного визита до оценки через 4 недели после завершения лечения. Результаты данного исследования свидетельствуют, что у детей с клиникой атопической экземы применение L. rhamnosus GG облегчает симптомы заболевания именно у пациентов с IgE-зависимой формой заболевания [78].
На настоящий момент имеются результаты нескольких мета-анализов, подтвердивших пользу от применения пробиотиков в лечении атопического дерматита.
В ходе опубликованного в 2008 г. мета-анализа проводилась оценка эффективности пробиотиков в лечении атопического дерматита, а также определялось влияние вида применяемого пробиотика, длительности терапии, возраста пациента, тяжести заболевания и IgE-опосредованной сенсибилизации на эффективность лечения [79]. Соответствующим критериям включения в мета-анализ оказались 10 исследований (общее количество пациентов — 678). Была выявлена статистически значимые различия снижения бальной оценки по шкале SCORAD при использовании пробиотиков по сравнению с плацебо (среднее изменение по сравнению с исходным состоянием −3,01; р=0,01). У детей со средне-тяжёлым заболеванием был получен наиболее благоприятный ответ на лечение. Длительность назначения пробиотика, возраст и вид используемого пробиотика не влияли на исход лечения. Таким образом, результаты данного мета-анализа продемонстрировали, что пробиотики оказывают умеренно выраженный эффект при лечении атопического дерматита у детей, причём наибольшая польза от назначения пробиотиков была выявлена у пациентов со средне-тяжёлой формой заболевания [79].
Источник


