Атопический дерматит обзор литературы

Доказательства неэффективности перечисленных выше лекарств, а также других альтернативных методов терапии АД явились предпосылкой для разработки нового направления научных исследований в этой области, поскольку дли-тельно сохраняющийся у ребенка зуд кожи не только негативно влияет на него самого, но и является стрессовой ситу-ацией для всей семьи, что делает лечение АД особенно сложной проблемой [6].
Исходя из иммунных механизмов патогенеза АД, наиболее перспективным подходом к его терапии представляется подавление функций Т-клеток и активности специфических цитокинов [7]. Уже проведены клинические испытания ряда препаратов — так называемых модуляторов цитокинов, в частности иммуномодуляторов CpGDNA, SRL 172, моди-фицированного эндотоксина (Lipid А) и др. [8-10].
Еще раньше в качестве ингибиторов синтеза цитокинов при бронхиальной астме и АД, наряду с ГКС, стали применять циклоспорин А [9]. Однако вьТяснилось, что, будучи неселективным ингибитором функций Т-лимфоцитов, он имеет целый ряд побочных действий, что ограничивает его использование, особенно в педиатрии [11, 12].
В 1980-е годы в Японии из макролактамного микроба Streptomyces tsukubaensis впервые была изолирована субстанция FK506, у которой ученые выявили иммуномодулирующие свойства, подобные циклоспорину А [13, 14]. Огромным преимуществом этого вещества явилась возможность его местного применения при воспалительных заболеваниях кожи [15]. Избирательное действие FK506 в коже основано на ингибировании фосфатазной активности кальциневрина и транскрипционного фактора Т-лимфоцитов [16]. Это приводит к супрессии продукции таких цитокинов, как IL-2, IL-4, IL-5, GM-CSF, что является основой терапевтического действия самого препарата, получившего торговое название Protopic (такролимус 0,03%, 0,1%),
В процессе дальнейших научных разработок из более чем 400 производных аскомицина путем ферментации Streptomyces hydroscopicus var. ascomyceticus был изолирован дериват SDZ ASM 981. Вначале этому веществу припи-сывали фунгицидное действие, однако спустя 20 лет была обнаружена чрезвычайно важная взаимосвязь между струк-турой SDZ ASM 981 и его иммуномодулирующими свойствами, проявляющимися в коже [17]. В дальнейшем эта суб-станция получила название пимекролимус (торговое название Элидел, компания Novartis, Германия, регистрационный номер П№014689/01 -2002). В Российской Федерации препарат разрешен к применению у детей с 6 мес.
Пимекролимус — бесцветное, растворимое соединение, механизм действия которого состоит в ингибировании акти-вации Т֊клеток [18]. В этих клетках пимекролимус связывается со специфическим цитозольным рецептором иммуно- филлина макрофиллином-12. Образовавшийся комплекс пимекролимус-макрофиллин-12 ингибирует фермент каль- циневрин-фосфатазу [19]. Кальциневрин — это Саг*/кальмо- дулин-зависимый протеин, который регулирует транслокацию цитозольных компонентов нуклеарного фактора активированных Т-лимфоцитов (NF-AT) в ядро. Комплекс пимекро- лимус-макрофиллин предотвращает образование и высвобождение различных провоспалительных цитокинов, осо-бенно Th,- (IL-2, IFNy) и Пъ-типов иммунного ответа (IL-4, IL-10) [18, 19]. В экспериментах на животных пимекролимус не влиял на высвобождение IL-8 из кератиноцитов, фиброб- ластов и эндотелиальных клеток [19]. Пимекролимус ингиби-рует также синтез и высвобождение из активированных тучных клеток гистамина, триптазы, TNFa, серотонина и гексо- заминидаз [18, 20]. Кроме того, он подавляет активность лейкотриена С4, но в меньшей степени, чем циклоспорин (32 и 60% соответственно) [21 ].
Все ингибирующие процессы наблюдаются лишь в том случае, если пимекролимус образует связь с макрофил-лином-12. При этом влияние ингибиторов кальциневрина на антиген-презентирующие клетки Лангерганса, которые играют ключевую роль при АД, существенно отличается от действия топических кортикостероидов.
Как известно, клетки Лангерганса инициируют и регулируют протективный эффект в коже за счет изменений своего фенотипа и функций. После взаимодействия с антигеном они перемещаются в лимфоузлы, где активируют нативные антиген-специфические Т-клетки, инфильтрирующие впоследствии воспалительные очаги кожи. Экспериментально было подтверждено, что только часть субпопуляции клеток Лангерганса экспрессирует на своей поверхности рецепторы макрофиллина, тогда как другая часть содержит их в малом количестве или даже не имеет совсем [22].
Давно известно, что аппликация кортикостероидов на кожу сопровождается исчезновением клеток Лангерганса и ухудшением их антиген-презентирующей функции в обработанной области [23, 24]. В отличие от кортикостероидов, пи- мекролимус не влияет на экспрессию ко-стимулирующих молекул и не ингибирует ни миграцию, ни созревание клеток Лангерганса [22]. A.Woiienberg et al. показали, что топическая аппликация другого ингибитора кальциневрина — та- кролимуса — снижает количество воспалительных дендритных эпидермальных клеток в коже больных АД, хотя популяция клеток Лангерганса остается без изменений [25]. В здоровой коже мышей не отмечено снижения количества и изменения фенотипа клеток Лангерганса после нанесения на кожу пимекролимуса [26].
Недавно W.Hoetzenecker et al. в экспериментах на коже мышей показали, что топические кортикостероиды индуцируют апоптоз клеток Лангерганса, тогда как пимекролимус не влияет на миграцию и функции этих иммунных клеток [27].
Поскольку топические кортикостероиды не обладают клеточно-селективным механизмом действия, они, в отличие от ингибиторов кальциневрина, вызывают атрофию кожи [28]. Пимекролимус обладает уникальной молекулярной структурой и большой молекулярной массой, которые придают ему липофильные свойства, в 20 раз превосходящие таковые та- -w кролимуса. Это позволяет пимекролимусу иметь высокое сродство к коже, в результате которого он меньше проникает через нее и, следовательно, имеет низкий системный эффект [16]. В опытах in vitro на коже мышей и человека было показано, что для пимекролимуса скорость прохождения через кожу в 60—110 раз меньше, чем для наружных кортикостероидов [29]. В отличие от такролимуса, пимекролимус не влияет также на иммунный ответ в регионарных лимфоузлах, а его системная иммуносупрессивная активность в 66 раз слабее, чем у такролимуса [30,31]. На модели животных было показано, что пимекролимус не обладает нефро- и гепатотоксичностью, не вызывает артериальной гипертензии [32].
Доклинические исследования продемонстрировали наиболее высокую эффективность и безопасность пимекроли-муса (1% крема), наносимого местно 2 раза в день, так же как и дальнейшие испытания Элидела при краткосрочном и длительном лечении АД у детей первого года жизни, более старшего возраста и у взрослых.
В одной из первых публикаций /.Но е! а1. сообщили об исследовании, включавшем 186 детей в возрасте 3-23 мес и 403 детей в возрасте 3-17 лет, страдающих АД легкого и среднетяжелого течения, которые получали лечение Элиде- лом на протяжении 26 нед (6 нед основной и 20 нед дополнительной открытой фазы, когда препарат использовали по клиническим показаниям) [33]. Значительное уменьшение выраженности зуда наблюдалось уже в течение 1-й нед при-менения крема Элидел (р < 0,001) по сравнению с плацебо. Через 6 нед у 54,5% детей 3-23 мес и 35% детей 3-17 лет кожа была чистой (или практически чистой по шкале ЕАЭ1, р < 0,001 по сравнению с плацебо). Элидел был особенно эффективен при нанесении на кожу лица и шеи (р < 0,001). Тахифилаксии или системных проявлений при долговременном применении препарата не отмечено.
Для оценки эффективности и безопасности крема Элидел при проведении длительной терапии АД у детей раннего возраста и старше 3 лет было проведено два клинических исследования [35, 36]. Из 204 детей раннего возраста, в тера- ֊^пии которых использовали крем Элидел, около 67% закончили 6-месячное лечение без обострений (по сравнению с 30,4% детей, получавших традиционные средства), независимо от степени тяжести АД [36]. Количество детей раннего возраста в группе пациентов, получавших крем Элидел, которым потребовалось дополнительное назначение тГКС, оказалось значительно меньше, чем в группе контроля (около 37% по сравнению с 65%). Причем раннее назначение Элидела способствовало предотвращению прогрессирования АД.
В другом долгосрочном исследовании у детей (средний возраст — 8 лет) из 474 пациентов 54% имели среднетяжелую форму АД, у 19,4% больных наблюдалось тяжелое или очень тяжелое течение заболевания [37]. За 12 мес лечения Элиделом обострений заболевания не было у 50,8% пациентов основной группы по сравнению с 28% пациентов из группы контроля. Вне зависимости от первоначальной тяжести АД лечение кремом Элидел способствовало значительному снижению частоты обострений, а также потребности в топических кортикостероидах по сравнению с пациентами, получавшими традиционную терапию. При длительном интермиттирующем использовании крема Элидел также отмечен лучший контроль АД, чем при применении обычных способов лечения.
У взрослых больных со среднетяжелым и тяжелым течением АД (л = 192) достоверное уменьшение зуда также от-мечено на 3-й день применения крема Элидел [38].
По данным Ь.ЕюЬепйеЮ и 1_.Веск противозудное действие Элидела отмечалось у больных чуть позже, к концу 1-й нед от начала терапии и длилось на протяжении всего периода его применения [39]. Препарат был эффективен и в качестве монотерапии [40]. Более того, оказалось, что трансдер- мальная абсорбция ингибиторов кальциневрина снижается при длительном их применении, а также при улучшении проявлений воспалительного кожного процесса [41, 42].
Клинические исследования Элидела более чем у 17 000 детей и взрослых, страдающих АД, подтвердили высокую безопасность препарата [43, 44]. Его концентрация в крови оставалась постоянно низкой и после повторных аппликаций, что подтверждено исследованием образцов крови более 8000 больных с АД, включая детей старше 3 мес [44].
Важно, что Элидел способен предотвращать развитие обострений АД и тем самым действенно контролировать течение заболевания. При его использовании документировано также достоверное снижение частоты применения топических кортикостероидов [37, 45, 46]. Так, в исследование У.Ое Ргоэ! и и^аЬп было включено 713 детей с АД в возрасте 2-17 лет, которые ранее использовали смягчающие средства и наружные кортикостероиды [45]. На протяжении 12 мес применения Элидела была полностью устранена потребность в топических кортикостероидах у 57% детей, при сравнении со стандартной терапией (32% детей). Через 6 мес у 61% пациентов, получавших Элидел, не отмечалось выраженных обострений болезни (34% в группе сравнения).
Подобным же образом Элидел действовал у детей в возрасте 3-23 мес (л = 251), у которых к концу 6-го мес терапии был достигнут контроль за течением АД: при использовании препарата в 70,1% случаев пациенты не имели обострений за-болевания по сравнению с 32,6% в контрольной группе; вдвое меньшим было также число детей, применявших тГКС [46].
Элидел (пимекролимус) имеет высокий профиль безопасности как при кратковременном, так и длительном примене-нии у детей, независимо от площади поражения кожи и степени тяжести течения АД [34, 42, 43]. Кроме того, препарат не накапливается в коже и не вызывает ее атрофии, что обычно выявляется уже на 8-й день применения наружных кортикостероидов в результате ингибирования ими местного синтеза коллагена [47-49].
Из побочных реакций Элидела иногда отмечаются усиление гиперемии, жжение или зуд в месте аппликации [37, 44].
Несомненно, такие результаты строгих клинических испытаний Элидела, как уменьшение частоты обострений АД у больных и снижение потребности в топических кортикостероидах при его использовании, свидетельствуют о стерои-досберегающем (т.е. снижающем потребность в тГКС) эффекте препарата [42, 50]. Тем самым, терапия Элиделом уже при самых ранних признаках АД может не только модифицировать течение заболевания, но и значительно улучшить качество жизни пациентов и ухаживающих за ними лиц [51].
Таким образом, в группе детей с АД Элидел показал себя более результативным, чем традиционная терапия. Его клинический эффект сравним с топическими кортикостероидами и достигнут при достоверно меньшем количестве побочных реакций. Кроме того, препарат имеет доказанное преимущество перед тГКС: он безопасен при нанесении на чувствительные участки кожи даже у детей старше 6 мес, в том числе с поражением до 92% площади поверхности тела.
Последние исследования показывают, что топические ингибиторы кальциневрина могут приравниваться по терапев-тической эффективности к наружным кортикостероидам слабого класса и тем самым представлять альтернативу гор-мональной терапии [52]. Немало публикаций посвящено также успешному применению топических ингибиторов кальци-неврина не только при АД, но и контактном аллергическом дерматите. Высказываются мнения о возможности их ис-пользования (в ряде случаев — доказанной) при лечении больных алопецией, эрозивной лихенизацией, изолированным ихтиозом, стероид-индуцированной розацеа, а также при реакциях отторжения [43, 53].
Таким образом, топические ингибиторы кальциневрина являются более мощными и менее токсичными препаратами, Чем циклоспорин А и местные кортикостероиды. Они хорошо переносятся детьми и взрослыми, страдающими АД, и практически лишены тех нежелательных явлений, которые присущи наружным кортикостероидам. Убедительные данные свидетельствуют о стероидосберегающем эффекте топических ингибиторов кальциневрина и позволяют считать их возможной альтернативой топическим кортикостероидам. ..
Выраженный противовоспалительный эффект, иммуномодулирующая способность и отсутствие побочных реакций делают Элидел идеальным препаратом для лечения АД у детей и взрослых.
Литература
Связь атопического дерматита, поллиноза и бронхиальной астмы у родителей с появлением атопического дерматита у детей раннего возраста
Изучение взаимосвязи между семейным анамнезом по атопическим болезням и развитием атопического дерматита (АД) у детей раннего возраста, а также оценить насколько влияет заболевание матери или отца на развитие этого заболевания у ребенка было целью исследования британских коллег. В исследование были включены матери, начиная с 8 недели беременности. У обоих родителей выяснялся аплергологический анамнез в отношении астмы, АД и поллиноза. Родители
отмечали симптомы АД у своих детей в возрасте 6, 18, 30 и 42 мес.
Атопический дерматит — одно из наиболее распространенных заболеваний, встречающихся во всех странах, у лиц обоего пола и в разных возрастных группах. По данным эпидемиологических исследований атопическим дерматитом (АД) в разных странах страдают от 10-28% детей; в общей структуре аллергических заболеваний он занимает одно из ведущих мест, чаще болеют женщины (65%), реже — мужчины (35%) (1). Заболеваемость атопическим дерматитом у жителей мегаполисов выше, чем у жителей сельской местности.
У детей атопический дерматит встречается в 1-4% случаев (до 10-15%) среди всей популяции, тогда как у взрослых — в 0,2-0,5% случаев (2).
Острота проблемы АД обусловлена не только его высокой распространенностью в детской популяции, но и ранним началом, быстротой развития хронических форм, приводящих к снижению социальной адаптации и инвалидизации ребенка. Дебют АД у 60-70% детей отмечается на 1-м году жизни (3). У 40-50% детей с АД в последующем развивается БА, поллиноз и/или аллергический ринит (4).
В последние годы интерес исследователей к атопическому дерматиту значительно возрос, что обусловлено неуклонным ростом распространенности заболевания в различных регионах мира. В развитых странах около 10-15% детей в возрасте до 5 лет страдают атопическим дерматитом. Доказана патогенетическая связь между атопическим дерматитом, бронхиальной астмой и аллергическим ринитом (5). Имеются данные об увеличении риска развития бронхиальной астмы у пациентов с тяжелым течением атопического дерматита (6).
До недавнего времени атопический дерматит считали сугубо аллергическим заболеванием. Атопия характеризуется генетически детерминированной предрасположенностью к синтезу IgE в ответ на низкие дозы аллергенов (как правило, белковой природы). Она выявляется по возрастанию уровня общего и/или специфических IgE в сыворотке крови и положительным результатам кожного тестирования с экзоаллергенами (7). Следует, однако, заметить, что примерно у четверти пациентов с данной патологией не выявляется сенсибилизация к аллергенам окружающей среды и отмечаются низкие уровни сывороточных IgE, т.е. нет данных за IgE-опосредованный механизм иммунных реакций. Это послужило поводом для дальнейшего изучения патогенеза заболевания и выработки новой стратегии терапии (8).
Атопический дерматит является, как правило, самым ранним клиническим проявлением атопии и наиболее часто встречающимся атопическим заболеванием у детей первых лет жизни (9). Кожные покровы ребенка раннего возраста не случайно становятся «органом-мишенью» аллергической реакции. Это связано с анатомо-гистологическими особенностями, а также характером иммунного ответа кожи на воздействие антигенов внешней среды у новорожденного и грудного ребенка (10). Собственно кожа (дерма) и подкожная жировая клетчатка детей раннего возраста представляют собой «средоточие» клеток, участвующих в распознавании, представлении антигенов и эффективном ответе на них. Подкожную жировую клетчатку детей раннего возраста считают ретикуло-гистиоцитарным органом, напоминающим по гистогенезу и функции костный мозг (11). В дерме имеется множество фиброцитов, гистиоцитов, лимфоцитов, плазматических, эндотелиальных клеток. Особенно важное значение придается факту наличия в коже и подкожной клетчатке множества тучных клеток. У детей раннего возраста коэффициент соотношения между площадью поверхности кожи и массой тела значительно выше, поэтому у них отмечается относительно большее число лимфоидных и тучных клеток в коже в сравнении с их количеством в других органах и тканях (12). У детей в возрасте от 3 мес педиатры фиксируют первые симптомы дерматита, развивающегося в наиболее обильно васкуляризованных областях кожи, а именно на щеках — области, более всего контактирующей с внешней средой, а также на ягодицах, подвергающихся постоянному раздражающему действию экскретов. Таким образом, кожные покровы ребенка в раннем возрасте становятся одним из основных органов, участвующих в формировании атопического типа ответа на антигенное воздействие, и, как следствие, основным «органом-мишенью» аллергической реакции (13).
Роль наследственной предрасположенности в формировании атопических заболеваний несомненна. Если оба родителя страдают каким-либо атопическим заболеванием, то риск развития его у ребенка составляет 70%. При болезни одного из родителей риск составляет 30% (14). Генетическая основа атопии доказана при обследовании близнецов: у гомозиготных близнецов совпадение проявлений атопического заболевания составляет 80%, у гетерозиготных — 20% (15). Основные исследования по наследованию атопических заболеваний проводились у больных с бронхиальной астмой и экстраполировались на все атопические заболевания, так как исследовались локусы, связанные с гиперпродукцией (IgE). Генетическая основа респираторной атопии была подтверждена идентификацией гена предрасположенности на хромосоме 11q13 у больных астмой; однако связь атопического дерматита с этим геном не установлена (16). В то же время обнаружено, что 60% детей, родители которых болеют атопическим дерматитом, также страдают этим заболеванием. Атопический дерматит развивается у 81% детей, если больны оба родителя, у 59% — если атопическим дерматитом болен один из родителей, а другой имеет признаки атопического поражения дыхательных путей и у 56% — если болен только один из родителей (16). Некоторые европейские исследователи склонны считать тип наследования атопического дерматита аутосомно-доминантным. Однако, по мнению большинства специалистов, в настоящее время с уверенностью можно говорить лишь о полигенном характере наследования атопического дерматита (17).
Атопический марш является естественным ходом развития проявлений атопии. Он характеризуется типичной последовательностью развития клинических симптомов атопической болезни, когда одни симптомы становятся более выраженными, тогда как другие идут на убыль. Обычно клинические симптомы атопического дерматита предшествуют появлению бронхиальной астмы и аллергического ринита. По данным нескольких исследований, приблизительно у половины пациентов с АД в дальнейшем развивается бронхиальная астма, особенно при тяжелом АД, и у двух третей — аллергический ринит (18). У детей с самым легким течением заболевания не было отмечено развития аллергического ринита или бронхиальной астмы. Степень тяжести атопического дерматита можно рассматривать как фактор риска бронхиальной астмы. По данным исследований, при тяжелом атопическом дерматите риск развития бронхиальной астмы составляет 70%, при легком — 30%, а в целом среди всех детей — 8-10% (19). Поэтому так важно, чтобы лечение было направлено не только на предотвращение обострений самого атопического дерматита, но и на то, чтобы предупредить развитие других форм атопической болезни.
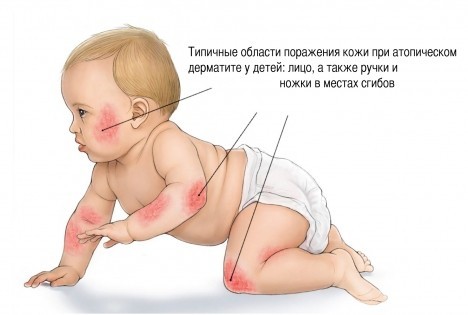
АД подразделяется на 3 последовательные фазы (20,30,36): младенческую, детскую и взрослую, и у каждой имеются характерные особенности. Младенческая форма наблюдается у ребенка с момента рождения до 2 лет. Излюбленная локализация: лицо, разгибательные поверхности конечностей, может распространяться на туловище. Характерно мокнутие, образование корок, сухость кожи. Часто обостряется при введении прикорма и при прорезывании зубов. Детская форма (2-12 лет): кожные высыпания преимущественно на сгибательной поверхности конечностей, на шее, в локтевых и подколенных ямках и на тыле кисти. Характерны гиперемия и отек кожи, лихенификация (утолщение и усиление кожного рисунка), папулы, бляшки, эрозии, трещины, расчесы и корочки. Трещины особенно болезненны на кистях и подошвах. Может отмечаться гиперпигментация век из-за расчесывания, появление характерной складки кожи под глазами под нижним веком (линия Денье-Моргана) (21). Во взрослой форме выделяется подростковая форма (до 18 лет). В подростковом периоде возможно как исчезновение высыпаний (чаще у юношей), так и резкое обострение дерматита с увеличением площади поражения, поражением лица и шеи (синдром красного лица), области декольте и кожи кистей рук, вокруг запястий и в локтевых ямках. Взрослая форма нередко продолжается в зрелом возрасте. Преобладает поражение сгибательных поверхностей в области естественных складок, лица и шеи, тыльной поверхности кистей, стоп, пальцев. Мокнутие обычно свидетельствует о присоединении вторичной инфекции (22). Но в любой фазе типичны сухость кожи, кожный зуд, утолщение кожи с усилением кожного рисунка (лихенификация), шелушение, гиперемия и типичные для каждого возраста высыпания. Формируется порочный круг: зуд — расчесы — сыпь — зуд (24). К обязательным критериям диагноза относятся зуд, хроническое рецидивирующее течение, атопия у самого больного или родственников и типичные по виду и локализации высыпания. Есть еще много дополнительных симптомов, не обязательных, но нередко очень ярких. Диагноз АД зависит от исключения таких заболеваний, как чесотка, аллергический контактный дерматит, себорейный дерматит, псориаз и ихтиоз (25).
В XXI в. произошли существенные изменения в изучении атопического дерматита (26): новейшие методы молекулярной генетики и биологии, междисциплинарный подход, активная научно-исследовательская работа способствовали прогрессу медицины в области патофизиологии и терапии этого заболевания.
Наиболее важные достижения, а также соответствующие рекомендации по лечению и профилактике АД были сформулированы экспертами США и Европейского Союза (ЕС) в согласительном документе «Диагностика и лечение атопического дерматита у детей и взрослых» в 2006 г. (31). В нем определение заболевания звучит коротко: «АД — хроническое воспалительное заболевание кожи, сопровождающееся зудом». Международная группа ученых рекомендует врачам при планировании лечения больных с АД использовать ступенчатый подход.
На всех стадиях течения АД больным показано основное лечение, которое включает соответствующий уход за кожей (очищение и гидратацию кожи с помощью увлажняющих/смягчающих средств и исключение/снижение влияния провоцирующих факторов), на фоне которого в дальнейшем назначают противовоспалительные препараты (32).
Уход за кожей основан на применении особых лечебных средств, достаточно широко представленных на современных фармацевтических рынках России. Местная противовоспалительная терапия включает всего лишь две группы лекарств — топические глюкокортикостероиды и топические ингибиторы кальциневрина (33). При осложнениях АД бактериальной/грибковой/вирусной инфекциями лечение следует продолжить наружными комбинированными или системными препаратами.
Системную терапию (антибиотики, пероральные кортикостероиды, циклоспорин А, азатиоприн, антигистаминные препараты) назначают больным с тяжелой формой АД, имеющим упорно рецидивирующее течение и/или другие сопутствующие заболевания (34). Взрослым и детям в возрасте старше 12 лет, страдающим тяжелым течением АД, возможно использование фототерапии. В последнее время рассматривается также целесообразность применения аллерген-специфической иммунотерапии в лечении АД (34).
Наружная (топическая) терапия является патогенетически обоснованной и абсолютно необходимой для каждого пациента с АД. Такая принципиальная важность топической терапии при АД объясняется несколькими факторами. Во-первых, АД — это хронический воспалительный процесс, который протекает в дерме, поэтому главное место в лечении заболевания должна занимать наружная терапия. Во-вторых, при АД крайне важно достичь восстановления и поддержания целостности кожного барьера, нарушение которой является кардинальным признаком АД, влекущей за собой усиление трансэпидермальной потери воды, а также повышение чувствительности кожи к различным ирритантам и аллергенам. Другим важным подходом является воздействие на сухость (ксероз) кожи при АД. Иными словами, наружная терапия — это именно тот вид лечения, который может изменить течение и исход АД (36).
АД, как правило, начинается в раннем детском возрасте. Согласно последней классификации, различают неатопическую и атопическую формы АД. По данным зарубежных исследователей, у 30-50% детей с типичной клинической картиной АД не удается подтвердить наличие атопических механизмов; у 15-45% детей описана преходящая (транзиторная) форма АД с низкими сывороточными уровнями IgE, не сопровождающаяся явной сенсибилизацией (37). Позднее некоторые случаи так называемой eczema infantum спонтанно разрешаются без развития типичного АД. У другой части детей, напротив, заболевание характеризуется формированием сенсибилизации. Novembre E. с соавторами, исследовав 111 детей в возрасте 2-11 лет, установили, что по данным кожных прик-тестов лишь через 9 лет более чем у половины из них отрицательные кожные пробы стали положительными (37).
К сожалению, не существует потенциальных и объективных маркеров, которые отражали бы степень тяжести и прогрессирования заболевания и которые могли бы быть использованы для оценки эффективности терапии.
В клинической практике для оценки степени тяжести течения АД чаще всего врачи используют такие критерии, как выраженность эритемы, инфильтрации, папулы (индексы IGA — Investigator’s Global Assessment, EASI — Eczema Area Severity Index), еще раньше с этой целью был предложен индекс SCORAD (Scoring Atopic Dermatitis), рекомендованный Европейской академией аллергологии и клинической иммунологии в 1992 г. (39) (данная система учитывает распространенность кожного процесса, интенсивность клинических проявлений и субъективные симптомы).
Вместе с тем, диагноз АД — прежде всего клинический. Основные подходы к наружной терапии при обеих формах АД одинаковы и ставят своей целью увлажнение/смягчение кожи и облегчение зуда. Лечение сухости кожи у больных АД проводят постоянно, тогда как, выбор противовоспалительных средств зависит от степени тяжести течения заболевания (38).
Для выработки стратегии, необходимой для каждого конкретного больного, страдающего АД, важная роль отводится сотрудничеству между пациентом (или родителями пациента) и аллергологом, педиатром и дерматологом (39).
Таким образом, комплексное лечение атопического дерматита с использованием широкого спектра современных фармацевтических средств позволяет значительно повысить эффективность проводимого лечения, добиваться пролонгирования клинической ремиссии и осуществлять контроль за течением заболевания.