Атопический дерматит по шабалову
Атопический дерматит (АД) — хроническое аллергическое заболевание кожи, которое развивается у лиц с генетической предрасположенностью к атопии. АД имеет рецидивирующее течение с возрастными особенностями клинических проявлений и характеризуется эксудативными и/или лихеноидными высыпаниями, повышением уровня сывороточного IgE и гиперчувствительностью к специфическим (аллергенным) и неспецифическим раздражителям. В недалеком прошлом, да и ныне, некоторые врачи предпочитают термину АД — детская экзема, что связано с характерным свойством пузырьковых поражений кожи быстро вскрываться, наподобие пузырьков кипящей воды (от греч. ekzeo — вскипать, вспыхивать).
Частота
АД диагностируют у 3-4% детей и примерно у трети больных в детских дерматологических стационарах.
Этиология
Роль наследственной предрасположенности в формировании АД несомненна. Установлено, что 60% детей, родители которых болеют АД, также страдают этим заболеванием.
Чаще всего в детском возрасте этиологическими факторами являются пищевые аллергены. Возможна этиологическая и триггерная роль аллергенов домашней пыли, эпидермальных, пыльцевых, грибковых, бактериальных и вакцинальных аллергенов.
Факторами, предрасполагающими к формированию псевдоаллергических реакций, являются: гиповитаминоз В6, и, возможно, других витаминов (В5, А, В)5);
дефицит микроэлементов, в частности, цинка;
дефицит ненасыщенных жирных кислот;
глистные и паразитарные инвазии;
нарушенные пищеварительные процессы (расщепления дисахаридов, белков, жиров);
холециститы и холецистопатии;
дисбактериозы кишечника;
избыток в продуктах питании ксенобиотиков и анутриентов, удобрений;
нейроциркуляторные дисфункции с недостаточной симпатикотонией (холинергический диатез).
Все перечисленные факторы способствуют развитию нестабильности мембран клеток (в частности, тучных), что сопровождается развитием кожных проявлений, клинически схожих с атопическим дерматитом.
К неаллергенным тригерным факторам относят:
изменения метеоситуации;
поллютанты;
курение (пассивное, а не только активное);
психоэмоциональные нагрузки.
Отрицательные климатические влияния (чрезмерно высокие или низкие температуры), нарушения правил ухода за кожей (раздражающее действие грубой одежды, химических веществ, горячей воды), плохие бытовые условия (высокая температура в сочетании с низкой влажностью), вакцинация, инфекционные заболевания могут усугублять воздействие причинных факторов.
Патогенез
Термин АД подразумевает иммунологический патогенез заболевания.
Клетки Лангерганса (белые отростчатые эпидермоциты, дифференцирующиеся из дендритных клеток, имеющие в цитоплазме специфические электронно-плотные гранулы пластинчатой структуры) находятся внутри эпидермиса и составляют примерно 2-4% всех эпидермальных клеток. За счет своей формы (в виде продольно вытянутых дендритов) и миграционной способности они образуют в межклеточном простран-стве равномерную сеть между кератиноцитами.
На поверхности клеток Лангерганса представлены рецепторы к Fc- фрагменту молекулы IgE. Наличие этих рецепторов на клетках Лангерганса является для АД строго специфичным, так как у больных бронхи-альной астмой без АД, а также у больных с контактным дерматитом эти рецепторы на клетках Лангерганса не выявлены.
При контакте с антигеном эти клетки могут покидать типичное надба- зальное местоположение и перемещаться в дистально и проксимально расположенные слои тканей.
Клетки Лангерганса выполняют функцию антигенпрезентирующих, преобразуя антигены в гранулах Бирбекка и выделяя их на поверхность мембраны.
В паракортексе антигенпрезентирующие клетки вступают во взаимо-действие с ThO-лимфоцитами, которые после распознавания антигена дифференцируются в ТЫ и ТЪ2-клетки. В поврежденных участках кожи больных АД доминируют активированные CD4+c фенотипом Th2, которые способствуют образованию В-лимфоцитами специфических IgE-антител и их фиксации на тучных клетках и базофилах.
Повторный контакт с аллергеном приводит к дегрануляции тучной клетки и развитию немедленной фазы аллергической реакции. За ней следует IgE-зависимая поздняя фаза реакции, характеризующаяся инфильтрацией тканей лимфоцитами, эозинофилами, тучными клетками, нейтрофилами, макрофагами.
Далее воспалительный процесс приобретает хроническое течение. Зуд кожи, который является постоянным симптомом АД, приводит к фор-мированию зудо-расчесочного цикла: кератоциты, повреждаемые при расчесывании, высвобождают цитокины и медиаторы, которые привлекают клетки воспаления в очаг поражения;
Кожа больных АД сухая, с повышенной трансэпидермальной потерей влаги. При штриховом раздражении кожи появляется белый дермографизм, имеющий все же вторичное происхождение
Особое значение в развитии и течении АД придают роли белка Staphylococcus aureus,в частности, его энтеротоксиновому суперантигену. Почти у 90% детей, больных АД, имеется колонизация кожных покровов Staph, aureus, способного обострять или поддерживать кожное воспаление посредством секреции ряда токсинов суперантигенов, стимулирующих Т- клетки и макрофаги. Около половины детей с АД продуцируют IgE-антитела к стафилококковым токсинам.
Особенности клеточного иммунитета у больных АД сводятся к угнетению клеточного» иммунитета, в частности к дефициту CD3 и С08-лимфоцитов (супрессоров), что приводит к повышенной склонности развития вирусных (Herpes simplex) и грибковых инфекций. Предрасположения к системным грибковым инфекциям и другим характерным проявлениям подавления клеточного иммунитета у больных АД нет.
/
Однако не у всех детей раннего возраста с дерматитом имеются признаки атопического диатеза и лабораторное подтверждение атопии. До 1 года высыпания на коже (чаще по типу детской экземы) могут быть проявлением так называемой транзиторной пищевой аллергии, обусловленной временным по- вышением уровня IgE или клиническими проявлениями псевдоаллергических реакций, характерных для детей с экссудативно-катаральной аномалией конституции. У этих больных имеет место повышенное спонтанное высвобождение биологически активных аминов из клеток-мишеней, связанное с синдромом нестабильности клеточных мембран, повышенная чувствительность клеток шокового органа к медиаторам анафилаксии, сниженная гистамино- пексия.
Либерация гистамина возможна под влиянием лектинов, содержащихся во многих фруктах, злаках, бобовых. Повышенная чувствительность клеток и сниженная гистаминопексия объясняют реакцию этих больных на продукты, содержащие гистамин (клубника, цитрусовые, бобовые, квашеная капуста, орехи, кофе и др.).
Практически у всех детей с неиммунной формой детской экземы имеется дискортицизм с некоторой недостаточностью секреции глюкокортикоидов, особенно при сравнении с гиперпродукцией минералокортикоидов; домини-рование холинергических процессов с угнетением адренергических.
Клиника
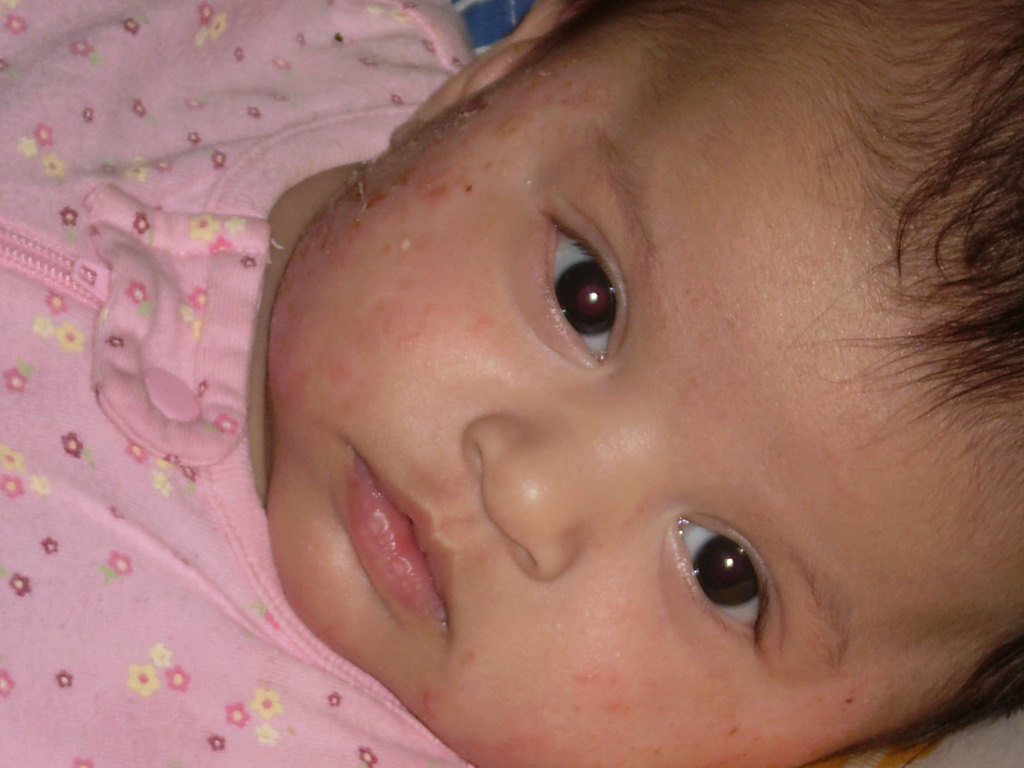
Примерно у 60% больных АД появляется на первом году жизни, у 90% — в течение первых пяти лет жизни. У Уз-2/з больных АД есть другие проявления атопической болезни (ринит, поллиноз, бронхиальная астма, аллергические поражения ЖКТ). Проявления АД весьма разнообразны — папулы, небольшие эпидермальные везикулы, эритематозные пятна, шелушение, струпья, трещины, эрозии и лихенизация. Характерный признак АД — сильный зуд. Т. Шер пишет, что зуд правильнее определить как «высыпающий зуд, но не зудящая сыпь».
У детей грудного возраста (младенческая форма — до 3 лет) отечные эритематозные мокнущие элементы (микровезикулы, серозные папулы), образующие крупные мокнущие участки, местами покрытые корочками, расположены преимущественно на лице, туловище, разгиба- тельных поверхностях, волосистой части головы.
В возрасте 3-12 лет (детская форма) — зудящие папулы с экскориация- Ми, лихенификация типичны на разгибательных поверхностях конечностей, тыле запястий, лице, в локтевых и подколенных ямках, микро- везикуляция обычно отсутствует
При подростковой форме (12-18 лет) поражается шея, сгибательные поверхности конечностей, запястья, верхние отделы груди (сливающаяся папулезная сыпь, выраженная лихенификация).
У людей молодого возраста — шея, тыльная поверхность кистей (по типу нейродермита).
Часто можно обнаружить участки гипопигментации на лице и плечах (белый лишай); характерную складку по краю нижнего века (линия Денье—Мор- гана); усиление рисунка линий ладони (атопические ладони); белый дермо-графизм.
Степень тяжести АД определяют по международной системе SCORAD с учетом объективных симптомов, площади поражения кожи, оценки субъективных признаков (зуд и нарушение сна).
АД часто осложняется вторичной бактериальной (стафилококки и стрептококки) инфекцией.
Диагностика
В клинической практике для постановки диагноза АД у детей следует ориентироваться на следующие признаки:
начало заболевания в раннем возрасте;
наличие аллергических заболеваний у родителей и/или родственников пробанда;
зуд кожных покровов различной интенсивности;
типичная морфология кожных высыпаний;
типичная локализация кожных высыпаний;
хроническое рецидивирующее течение;
высокий уровень общего IgE и аллерген-специфических IgE-антигенов в сыворотке крови.
Прик-тест или кожные скарификационные пробы проводят в периоде ре- Миссии заболевания. При невозможности проведения; кожных проб (обострение заболевания) проводят диагностику in vitro. Для диагностики также проводят элиминационно-провокационные пробы с пищевыми продуктами.
Дифференциальный диагноз проводят с:
себорейным дерматитом;
контактным дерматитом;
синдромом Вискотта—Олдрича (дерматит, тромбоцитопения, рецидивирующие инфекции);
синдромом гипериммуноглобулинемии Е (высокий уровень общего IgE в сыворотке крови, дерматит, рецидивирующие инфекции);
десквамативной эритродермией Лайнера — Муссу;
герпетическим и герпетиформными дерматитами;
микробной экземой;
розовым лишаем;
наследственным нарушением обмена триптофана;
чесоткой.
Лечение
Три основных направления лечения детей с АД:
Диетотерапия.
Местная терапия.
Общее (системное) лечение.
Принципы диетотерапии изложены в разделе, посвященном лечению пищевой аллергии. Для детей любого возраста элиминационную диету строят на основе достоверно доказанной роли того или иного пищевого продукта в развитии обострений АД. Абсолютным критерием является положительный результат специфического аллергологического обследования и убедительные свидетельства анамнеза о провоцирующей роли данного продукта в обострении заболевания.
Большое значение в лечении как иммунопатологических, так и неиммун-ных форм дерматита имеет ограничение сахара, соли (как веществ, усиливающих экссудативные проявления); бульонов, острых, соленых и жареных блюд, которые могут усилить проницаемость ЖКТ для аллергенов. Для приготовления пищи используют очищенную фильтрами воду. Овощи и крупы перед варкой вымачивают. Следует избегать использования в пищу продуктов промышленного консервирования, которые содержат красители, консерванты, эмульгаторы.
Целесообразно периодически проводить копрологическое исследование и по результатам его решать вопрос о заместительной пищеварительной фер- ментотерапии.
К сожалению, вода из водопровода во многих городах России не соответ-ствует стандартам для питьевой воды, и оптимально для приготовления пищи детям с АД не пользоваться водой из водопровода, покупать специальную очищенную воду или пользоваться проверенной колодезной.
Быт. Необходима элиминация бытовых аллергенов. Одежда должна быть только из хлопка, не показаны шерстяные и синтетические вещи. Следует избегать мыла и моющих средств, обезжиривающих кожу. Белье необходимо стирать только детским мылом. Оптимальным для больного является умеренно теплый климат. Повышенная потливость усиливает зуд, приводит к обострению АД. Умеренные солнечные ванны, УФО, морские ванны оказывают положительное влияние на кожу многих детей с АД.
Наружная терапия направлена на:
устранение или уменьшение воспалительных изменений на коже и кожного зуда, сухости кожи;
восстановление структуры и функции кожи;
профилактику и устранение вторичного инфицирования пораженных участков кожи;
восстановление поврежденного эпителия.
Необходимо ограничение воздействия провоцирующих обострение факторов. Ногти на пальцах рук у ребенка должны быть коротко острижены, чтобы уменьшить повреждение кожи при расчесывании. После мытья в прохладной воде с нейтральным мылом следует использовать смягчающие кремы или масла.
Наружное лечение начинают с применения индифферентных паст, мазей, болтушек, содержащих противовоспалительные, кератолитические и керато- пластические средства. При обострении с экссудативными проявлениями применяют примочки с жидкостью Бурова (раствор алюминия ацетата), 1% раствора танина и др.
При выраженных проявлениях АД назначают топические глюкокортико- стероиды (ГКС) — Элоком (крем, мазь, лосьон), Адвантан (эмульсия, крем, мазь). Эти препараты обладают высокой эффективностью и безопасностью. Их назначают 1 раз в сутки в период обострения, в том числе и у детей раннего возраста. Нерациональное использование ГКС может вызвать системные и локальные побочные эффекты.
При присоединении вторичной бактериальной инфекции назначают наружные антибактериальные препараты (Бактробан, 3-5% пасты с эритромицином, линкомицином). Предварительно пораженные участки кожи обрабатывают фукорцином, раствором бриллиантового зеленого, метиленового синего. При грибковой инфекции применяют наружные противогрибковые препараты (кремы Травоген, Низорал и др.)
При выборе медикаментозного средства системного действия руководствуются возрастом больного, периодом болезни, наличием сопутствующих заболеваний.
Показанием для назначения антигистаминных препаратов является обо-стрение заболевания. Используют препараты I, II и III поколений (см. табл. 62). Седативный эффект препаратов I поколения используют для снятия зуда, нарушающего сон ребенка. При необходимости длительной терапии (проти- ворецидивное лечение) используют антигистаминные препараты II поколения (зиртек, кларитин, кетотифен, телфаст).
К мембраностабилизирующим препаратам, являющимся препаратами выбора при синдроме нестабильности клеточных мембран, относят Кетотифен, Ксидифон, антиоксиданты (витамины А, Е, С, полиненасыщенные длин- ноцепочечные жирные кислоты и др.), Налкром. Повышению эффективности лечения АД способствует назначение витаминов В6 (в лечебных дозах от 50 до 100 мг/сутки в 2 приема в первой половине дня 1 мес) и В15 (пантотенат кальция 0,05-0,1 г 2 раза в сутки 1 мес). Перспективным является применение b-каротина, который является источником поступления в организм витамина А и повышает устойчивость мембран лизосом и митохондрий к действию метаболитов токсических веществ, стимулирует иммунную систему и регу-лирует перикисное окисление липидов.
Полезно назначение препаратов кальция (глюконат, лактат, глицерофосфат по 0,25-0,5 г внутрь 2-3 раза в день) и/или фосфора, фитотерапии (корень солодки, стимулирующий функцию надпочечников и его препарат гли- цирам и др.). У ряда детей показан хороший эффект от трехмесячных курсов сочетанного приема желудочных капель и экстракта элеутерококка.
В связи со значимостью пищеварительной недостаточности в генезе дер-матита, после копрограммы решают вопрос о целесообразности назначения пищеварительных ферментов(Фестал, Дигестал, Панзинорм, Панкреатин и др.), желчегонных средств. Если имеется лямблиоз, хеликобактериоз, гель- минтозы — показана специфическая терапия. Необходимо лечение дисбактериоза кишечника.
При выраженной пиодермии и неэффективности местной антибактери-альной терапии назначают антибиотики парентерально с учетом чувствительности флоры. При эмпирическом назначении антибиотиков преимущество отдают макролидам, цефалоспоринам I и II поколений, линкомицину. В настоящее время для лечения детей с атопическими болезнями в период ремиссии предложен отечественный препарат из золотистого стафилококка Рузам (подробности см. Приложение 4).
Прогноз
Полное клиническое выздоровление наступает у 17-30% больных. Небла-гоприятными факторами прогноза АД являются:
начало стойких высыпаний на коже в возрасте 1-3 мес;
сочетание АД с бронхиальной астмой;
сочетание АД с персистирующей инфекцией;
сочетание АД с вульгарным ихтиозом;
неадекватная терапия.
При псевдоаллергическом механизме развития АД прогноз более благоприятный. У большей части детей кожный процесс уменьшается к полутора- двум годам и исчезает к пяти.
Еще по теме АТОПИЧЕСКИЙ ДЕРМАТИТ:
- АТОПИЧЕСКИЙ ДЕРМАТИТ
- Дерматит атопический
- Атопический дерматит (экзема)
- АТОПИЧЕСКИЙ ДЕРМАТИТ
- Дерматит атопический. Нейродермит
- Глухота нейросенсорная и атопический дерматит
- 11.10.5. Атопический хейлит
- Атопическая форма
- Обострение атопического дерматита
- СЕБОРЕЙНЫЙ ДЕРМАТИТ
- АТОПИЧЕСКИЙ НЕЙРОДЕРМИТ (ЭНДОГЕННАЯ ЭКЗЕМА)
- АТОПИЧЕСКИЙ НЕЙРОДЕРМИТ (ЭНДОГЕННАЯ ЭКЗЕМА)
- Контактный дерматит
Источник
Автор статьи аллерголог Ася Валерьевна Кудрявцева
Атопический дерматит и пищевая аллергия.
Разве что совсем ленивый не написал пост про эти два состояния. Я тоже не могу обойти их вниманием.
С трибун Европейского конгресса, в кулуарах после докладов ведущих мировых специалистов аллергологи, дерматологи и педиатры обсуждают вопросы эффективного использования различных вариантов противовоспалительного лечения атопического дерматита, необходимость и возможность терапевтического влияния на колонизацию пораженной кожи условно-патогенной флорой, участие в развитии болезни пищевой сенсибилизации. .
Отечественный специалист:
«А как же гипоаллергенная диета матери? обязательный гипоаллергенный стол подростку? А почему вы не назначаете в дебюте заболевания лечебные смеси? У нас, в России, принято в первую очередь искать триггеры обострения, ожидая положительный эффект после их устранения без использования наружного лечения»
Западный специалист:
«Не помню, когда рекомендовал в последний раз детям с атопическим дерматитом аминокислотные смеси. В России назначают в дебюте гидролизаты? Зачем? Это же дорого. Мы неплохо справляемся с обострением болезни, используя противовоспалительную наружную терапию. Атопический дерматит — заболевание кожи, мы в первую очередь лечим пораженную кожу.»
«Некоторое время назад атопический дерматит описывали как аллергическое заболевание кожи,» — уточняет один из ведущих европейских специалистов по пищевой аллергии, — «сегодня вклад аллергических реакций в развитии этого заболевания оспаривается, предполагается, что аллергия скорее является следствием атопического дерматита у больных с сопутствующими особенностями соматической конституции……»
Консультация ребенка с атопическим дерматитом в России. Разговор с мамой:
— Вашему ребенку восемь месяцев. Он болеет пол года. Какие Вы выполняете назначения врача?
— Отменили грудное вскармливание из-за прогрессирующего течения атопического дерматита. Перевели ребенка с лечебной смеси на основе полного гидролиза молочного белка на аминокислотную смесь.
— Как долго ребенок получает эти лечебные смеси?
— Больше 4-х месяцев.
— Вы ввели какой-либо прикорм?
— Нет.
— Вы отмечаете положительный сдвиг в состоянии ребенка после отмены грудного вскармливания, перевода ребенка на кормление аминокислотной смесью?
— Нет
— Вы получали противовоспалительное наружное лечение?
— Нет, только эмоленты.
Публикация 2018 года:
«……некоторые варианты пищевой аллергии могут быть предотвращены ранним введением потенциально опасных пищевых аллергенов для детей с повышенным риском…»
https://www.ncbi.nlm.nih.gov/pubmed/29750772
Исследование LEAP:
«… регулярное потребление арахиса, начиная с первых 11 месяцев жизни, эффективно предотвращает развитие аллергии на арахис» https://www.leapstudy.com/leap-study-results#.WwymrFMv..
Клинические рекомендации по атопическому дерматиту, Россия, 2015 г:
«Однако даже при отсутствии пищевой
сенсибилизации и клинических реакций на пищу, гипоаллергенная диета у больных с
атопическим дерматитом способствует уменьшению суммарного действия триггерных факторов,
способствующих обострению кожного процесса.»
В настоящее время весь мир разрабатывает рационы для детей первых 6 месяцев жизни, включающие в себя потенциальные пищевые аллергены, доказывая позитивную роль их раннего введения в снижении риска возникновения тяжелых аллергических реакций у детей группы высокого риска. Мы же позволяем иммунной системе развиваться без какой-либо ее стимуляции пищевыми антигенами, ограничивая употребление в пищу молочного белка и других продуктов нередко даже у абсолютно здоровых детей, называя пищевой аллергией все, даже функциональные, нарушения (младенческие акне, разжижение стула, колики, непереносимость лактозы и многое др), свойственные раннему возрасту.
Источник
Notice: Trying to access array offset on value of type bool in /var/www/www-root2/data/www/adm-bizhbulyak.ru/wp-content/themes/arianna/library/core.php on line 498