Интерлейкины при атопическом дерматите
Атопический дерматит (АтД) — хроническое заболевание, начинающееся в раннем детском возрасте, нередко продолжающееся в течение всей жизни и характеризующееся, как правило, стадийностью развития воспалительного процесса на коже. Заболевание сопровождается интенсивным зудом, нередко нарушающим сон и приводящим к физической и эмоциональной дезадаптации пациента и членов его семьи. АтД сопровождается симпатергической реакцией кожи (белый дермографизм) и связан с особым наследственным предрасположением к аллергии — атопией. АтД является одним из наиболее распространенных дерматозов (от 20% до 40% в структуре кожных заболеваний) и встречается во всех странах, у лиц обоего пола и в разных возрастных группах [1].
Патогенез АтД до настоящего времени во многом остается неясным, однако ведущая роль иммунных нарушений в развитии АтД не вызывает сомнений; в частности, это убедительно доказывают наблюдения за развитием АтД после пересадки костного мозга от больных с атопической предрасположенностью и у больных с тяжелыми дефектами Т-клеточного иммунитета с синдромом Вискотта–Олдрича. Так называемое «экзематозное извержение» является особенностью синдрома и диагностическим критерием для АтД, оно резко исчезает после успешного трансплантата костного мозга, что предполагает, что иммунная дисфункция непосредственно участвует в патогенезе АтД [2].
Наиболее часто иммунные нарушения у больных АтД манифестируются эозинофилией в периферической крови, повышенным содержанием в сыворотке крови IgE, увеличением популяций CD23+ моноцитов с активированными T-хелперами 2-го типа (продуцирующих ИЛ-4, ИЛ-5 и ИЛ-13); сокращением популяций CD8+ лимфоцитов с активированными T-хелперами 1-го типа (продуцирующих ИФН-γ); активированным состоянием макрофагов с активным синтезом гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ), простагландина Е, ИЛ-10; повышенным содержанием растворимых молекул клеточной адгезии (E-селектин, VCAM-1, ICAM-1), катионных белков эозинофилов; повышением спонтанного выброса гистамина базофилами [3].
Интерлейкины играют важную роль на всех стадиях реализации атопических реакций. Показано, что при АтД отмечаются иммунные нарушения регуляции функциональной активности Т-лимфоцитов. Важным звеном в патогенезе этого заболевания является сдвиг Th1/Th2-цитокинового профиля в сторону Th2-реакций [4], который сопровождается усилением секреции IgE. Показано, что ИЛ-4 и ИЛ-10 играют ключевую роль в развитии аллергического воспаления. Данные интерлейкины взаимодействуют со своими рецепторами на В-клетках и активируют синтез иммуноглобулина Е (IgE) [5, 6].
ИЛ-4 синтезируется СD4 и CD8 Т-лимфоцитами, тучными клетками и эозинофилами [7]. Считается, что ИЛ-4 играет важную роль в инициации иммунного ответа; выполняя роль медиатора дифференцировки предшественников Т-хелперов в Th2, предотвращая апоптоз Th2-лимфоцитов, он способствует поддержанию аллергического иммунного ответа [8]. ИЛ-4 ограничивает синтез макрофагами провоспалительных ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12, ФНО-α. ИЛ-4 служит кофактором пролиферации неактивных В-лимфоцитов, а также индуцирует в этих клетках синтез IgE и IgG4. Дисрегуляция секреции ИЛ-4 является ключевой в развитии аллергической патологии. Увеличение синтеза IgE в ответ на стимуляцию ИЛ-4 приводит к усилению IgE-стимулированного синтеза цитокинов тучными клетками, способными вырабатывать ИЛ-4 и ИЛ-6. Кроме того, ИЛ-4 стимулирует экспрессию сосудистых молекул адгезии-1, увеличение концентрации которых происходит на поверхности эндотелиальных клеток вследствие воспалительного процесса. Сосудистые молекулы адгезии-1 обеспечивают миграцию эозинофилов и моноцитов в очаг воспаления, т. е. клеточную инфильтрацию, характерную для развития последней фазы атопической реакции. При наличии островоспалительных изменений в участках кожного поражения определялось повышение продукции ИЛ-4 [9].
ИЛ-10, продуцируемый Th2, может рассматриваться как антагонист ряда цитокинов. ИЛ-10 подавляет продукцию ИФН-g Th1-цитокинового профиля; также он тормозит пролиферативный ответ Т-клеток на антигены, подавляет секрецию активированными моноцитами ИЛ-1В, ИЛ-6 и ФНО. ИЛ-10 стимулируют секрецию иммуноглобулинов B-клетками, также ИЛ-10 может стимулировать синтез IgE. Основной функцией ИЛ-10 является защита тканей от повреждения при воспалении. Этот интерлейкин обладает иммунорегуляторными свойствами и относится к числу противовоспалительных; он подавляет секрецию цитокинов Т-хелперами 1-го типа, контролируя таким образом балансTh1/Th2 и осуществляя регуляцию воспалительного ответа по принципу отрицательной обратной связи [10]. ИЛ-10 подавляет функции антиген-презентирующих клеток, а также продукцию провоспалительных цитокинов, в том числе ИЛ-1, способствуя уменьшению таких симптомов АтД, как выраженный зуд, инфильтрация и гиперемия [11]. В своем ингибирующем действии на клеточный иммунитет ИЛ-10 синергичен с ИЛ-4. У больных АтД с повышенным уровнем ИЛ-10 в коже отмечается ослабление противоинфекционной защиты вследствие снижения содержания антимикробных пептидов [12], что, следовательно, повышает риск развития инфекционных осложнений на коже больных АтД.
Основные принципы терапии АтД
Выбор терапии в каждом случае зависит от вида, тяжести и продолжительности АтД. Однако, с учетом иммунологических механизмов развития АтД, особый интерес представляют методы лечения, которые могут корректировать иммунные нарушения. Разными исследователями давно предпринимаются попытки связать возникновение и развитие иммунозависимых дерматозов с изменениями сывороточных уровней цитокинов. На основе полученных знаний продолжаются попытки разработать новые фармацевтические лекарственные средства. Современным методом лечения тяжелых дерматозов является применение препаратов, полученных с помощью биотехнологических технологий, так называемых биологических препаратов, на фоне постоянного применения которых наступает и сохраняется выраженное клиническое улучшение или ремиссия [13]. Например, одним из таких препаратов является инфликсимаб, который активно используется для лечения псориаза. Механизм действия препарата заключается во влиянии на цитокиновый профиль Th1-типа, связанный с повышением уровня ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-7, ИЛ-8, ИФН-γ и ФНО-α [14]. В настоящее время предпринимаются подобные попытки применения иммунотропных препаратов и при лечении АтД, например Циклоспорина А, который селективно ингибирует экспрессию генов, участвующих в ранних этапах активации Т-лимфоцитов, в результате чего Т-лимфоцит прекращает синтезировать цитокины, не происходит пролиферации клеток и подавляется иммунное воспаление. Из-за снижения числа активных Т-лимфоцитов, которые экспрессируют рецепторы для ИЛ-2, подавляется продукция таких цитокинов, как ИЛ-3, ИЛ-4 и ИЛ-5. Однако препарат обладает рядом побочных эффектов, вследствие которых лечение им проводится только больным с рефрактерным течением болезни под строгим наблюдением специалистов [15].
Также давно известно, при АтД отмечается тенденция к улучшению в летнее время и ухудшению зимой. Еще в начале 20-х гг. прошлого века было показано, что морской климат положительно влияет на течение АтД, а в 1948 г. были изучены положительные эффекты ультрафиолетового излучения [16]. Научные достижения в фотоиммунологии и молекулярной биологии позволили объяснить механизм действия фототерапии: она воздействует на воспалительные клетки, такие как нейтрофилы, эозинофилы, макрофаги, клетки Лангерганса, изменяет продукцию цитокинов и обладает выраженным антибактериальным эффектом [17]. В частности, известно, что фототерапия лучами УФ-спектра, применяемая для лечения больных со среднетяжелыми и тяжелыми формами течения АтД, способна оказывать нормализующее влияние на их иммунный статус. Установлено, что терапия низкими (5–20 Дж/см2) и средними (30–40 Дж/см2) дозами ультрафиолетового излучения УФА-1-диапазона с длиной волны 350–400 нм приводит к существенному снижению содержания CD4+ лимфоцитов и ИФН-γ в очагах поражения кожи, что свидетельствует об иммуносупрессивном действии УФА-1-излучения [18]. Показано, что фототерапия с применением средневолнового ультрафиолетового излучения 311 нм (УФБ 311 нм) у больных псориазом приводила к достоверному снижению изначально повышенных уровней провоспалительных и регуляторных цитокинов ИЛ-1, ФНО-α, ИЛ-2 и ИФН-γ, а также к повышению изначально сниженного уровня противовоспалительного цитокина ИЛ-4, что коррелировало с положительным клиническим эффектом [19]. Однако в доступной литературе не выявлено сведений о влиянии УФ-терапии на уровни ИЛ-4 и ИЛ-10 у больных АтД.
В настоящее время сведения о существенной роли ИЛ-4 и ИЛ-10 у пациентов с АтД в отечественной литературе недостаточны. Также немногочисленны данные о влиянии фототерапии УФБ 311 нм на сывороточные уровни ИЛ-4 и ИЛ-10 у больных АтД.
Целью данного исследования было изучить взаимосвязь клинических проявлений и течения кожного процесса у больных АтД с сывороточными уровнями ИЛ-4 и ИЛ-10; изучить динамику сывороточных концентраций ИЛ-4, ИЛ-10 у больных АтД на фоне проведения стандартной медикаментозной терапии в сочетании с УФ-терапией и оценить корреляцию эффективности терапии с уровнями изучаемых интерлейкинов.
Материалы и методы исследования
В исследование были включены 35 больных АтД — 19 женщин и 16 мужчин в возрасте от 17 до 57 лет. Степень тяжести АтД устанавливалась в соответствии с клиническими критериями — «scoringatopicdermatitis» (SCORAD). У всех пациентов, включенных в исследование, диагностировано среднетяжелое течение АтД, они находились на стационарном лечении и получали стандартную терапию, адекватную обострению АтД, согласно Федеральным клиническим рекомендациям по ведению больных с атопическим дерматитом от 2015 г. [1], в том числе пациенты получали антигистаминные препараты — хифенадин 25 мг по 1 таблетке 2 раза в день — 14 дней, курс фототерапии по методике УФБ 311 нм ежедневно, всего 12 процедур на курс лечения; наружное лечение включало топические глюкокортикостероидные препараты — крем аклометазон и мазь мометазон.
Контрольную группу составили 11 практически здоровых добровольцев (без АтД), 5 мужчин и 6 женщин в возрасте от 25 до 40 лет.
Проводилось иммунологическое исследование: определение концентраций сывороточных уровней ИЛ-4 и ИЛ-10 методом ELISA на аппарате MULTISKANGO (ThermoFisherScientific, США) с помощью тест-систем производства «Вектор-Бест» (Россия). Исследование в основной группе наблюдения проводилось дважды: при поступлении в стационар в период обострения заболевания и после проведения курса фототерапии, в контрольной группе — однократно.
Полученные результаты и их обсуждение
В результате проведенного лечения к окончанию курса терапии клиническое излечение констатировано у 5 больных АтД, значительное улучшение — у 24 больных, незначительное улучшение — у 5 больных; эффект от лечения отсутствовал у 1 больного.
Результаты оценки содержания исследованных интерлейкинов в образцах сыворотки крови представлены в табл. 1 и 2.
Таким образом, в результате исследования показано, что у больных АтД на фоне обострения заболевания отмечается умеренное повышение сывороточной концентрации ИЛ-10; после проведенной фототерапии у пациентов с АтД уровни ИЛ-10 также значимо превышали сывороточные показатели у здоровых доноров на 9,7% (табл. 1). В отношении уровней ИЛ-4 статистически значимых различий до и после лечения выявлено не было (табл. 2).
Заключение
Сывороточные уровни ИЛ-4 у больных АтД существенно не отличались от таковых у здоровых доноров; также существенно не изменились они на фоне проведенного лечения с включением курса фототерапии УФБ 311 нм и достигнутой клинической ремиссии — следовательно, можно предположить, что роль данного цитокина в иммунопатогенезе АтД не является ведущей и дальнейшие поиски новых терапевтических подходов к данному заболеванию следует вести в иных направлениях. В то же время анализ сывороточных уровней ИЛ-10 у пациентов с АтД показал их повышение примерно на 19,4% по сравнению с таковыми у здоровых добровольцев в контрольной группе — это свидетельствует о значимости данного интерлейкина в механизмах регуляции иммунопатологических состояний, приводящих к развитию АтД. Следовательно, объединенные усилия дерматологов, иммунологов и специалистов других фундаментальных и клинических специальностей следует направить на поиск возможности влияния на данный патогенетический фактор.
Литература
- Прошутинская Д. В., Чикин В. В., Знаменская Л. Ф. и др. Федеральные клинические рекомендации по ведению больных атопическим дерматитом. 2015. [Электронный ресурс]. Режим доступа: https://www.cnikvi.ru/docs/clinic_recs/bolezni-kozhi-i-pridatkovkozhi/atopicheskiy_dermatit.
- Saurat J.-H. Eczema in primary immune-defficiencies: clues to the pathogenesis of atopic dermatitis with special reference to the Wiskott-Aedrich syndrome // Acta Derm Venerol. 1985; Vol. 114: 125–128.
- Сергеев А. Ю., Караулов А. В., Сергеев Ю. В. Иммунологические основы патогенеза главных воспалительных дерматозов человека // Иммунопатология, аллергология, инфектология. 2003. № 3. С. 10–23.
- Саликова Т. И. с соавт. Мутации в гене филаггрина как предрасполагающий фактор развития атопического дерматита // Клиническая дерматология и венерология. 2010. № 3. С. 4–7.
- Яриллин А. А. Основы иммунологии. М.: Медицина, 1999. 608 с.
- Гималова Г. Ф., Карунас А. С., Хуснутдинова Э. К. Молекулярно-генетические аспекты атопического дерматита // Медицинская генетика. 2012. № 12. 19 с.
- Балаболкин И. И., Тюменцева Е. С. Влияние генетических факторов на развитие атопического дерматита у детей // Педиатрия. 2009 Т. 27. № 2. С. 125–129.
- Виноградова Т. В. и соавт. Современная оценка цитокинового статуса детей при атопическом дерматите // Российский вестник перинатологии и педиатрии. 2014. № 1.
- Чебуркин А. А., Смолкин Ю. С. Профилактика атопического дерматита // Аллергология и иммунология в педиатрии. 2004. № 1. С. 59.
- Чистова И. Я. Роль атопии в формировании профессиональных аллергодерматозов. Автореф. дис. … к.м.н.: 14.02.2004. М., 2013. 17 с.
- Петрищева И. В., Цибиков Н. Н., Фефелова Е. В. Динамика интерлейкинов при атопическом дерматите в период обострения и ремиссии // ЭНИ Забайкальский медицинский вестник. 2014. № 4. С. 101–104.
- Ong P. Y., Ohtake T., Brandt C. et al. Endogenous antimicrobial peptides and skin infections in atopic dermatitis // N. Engl. J. Med. 2002. Vol. 34. P. 1151–1160.
- Кубанов А. А., Матушевская Ю. И. Опыт применения препарата Инфликсимаб в лечении больных тяжелыми формами псориаза // В помощь практикующему врачу. 2008. № 6. С. 75–80.
- Кочергин Н. Г., Смирнова Л. М., Айрапетян Н. Р. Инфликсимаб в терапии псориаза // В помощь практикующему врачу. 2005. № 5. С. 37–39.
- Кудрявцева А. В. Циклоспорин А при атопическом дерматите у детей: мифы и реальность терапии тяжелых форм заболевания // Вопросы практической педиатрии. 2015. Т. 11. № 4. С. 85–90.
- Nexman P. N. Clinical Studie’s of Besnier’s Prurigo. Dissertation. Copenhagen: Rosenkide and Bagger, 1948.
- Grundmann S. A., Beissert S. Modern aspects of phototherapy for atopic dermatitis // J Allergy (Cario). 2012; 2012: 1211797.
- Авиденко И. Н., Кубанов А. А. Эффективность дальней длинноволновой ультрафиолетовой терапии у больных атопическим дерматитом // Вестник дерматологии и венерологии. 2009. № 3. С. 61–63.
- Талыбова А. М. Ближайшие и отдаленные результаты фототерапии средневолновым ультрафиолетовым излучением 311 нм с учетом изучения иммунного статуса и морфофункционального состояния кожи больных псориазом. Автореф. дис. … к.м.н.14.02.2010. М., 2011. 17 с.
И. В. Кошелева1, доктор медицинских наук, профессор
А. Р. Хасанова
ГБОУ ДПО РМАНПО МЗ РФ, Москва
1 Контактная информация: irina@msk.org.ru
Современные терапевтические подходы к атопическому дерматиту: роль фототерапии и поиск новых путей/ И. В. Кошелева, А. Р. Хасанова
Для цитирования: Лечащий врач № 4/2018; Номера страниц в выпуске: 24-26
Теги: кожа, хроническое заболевание, дерматоз, аллергия
Купить номер с этой статьей в pdf
Атопический дерматит относится к одному из сложнейших заболеваний детского возраста. Начинаясь у детей первых месяцев жизни, заболевание приобретает хроническое течение, проходя определенную возрастную эволюцию клинических проявлений, вовлекая в патологический процесс не только кожу, но и другие органы и системы [1, 2].
В последние десятилетия достигнут существенный прогресс в понимании сути сложных механизмов, провоцирующих развитие и поддерживающих течение атопического дерматита. Известно, что в иммунологические механизмы острой и хронической фазы атопического дерматита вовлечены разнообразные иммунокомпетентные клетки: кератиноцины, дендритные клетки, клетки Лангерганса, эозинофилы, тучные клетки и Т-лимфоциты [3]. Показано, что дисбаланс иммунорегуляторных механизмов у лиц с атопией приводит к избирательному апоптозу Т-хелперов 1-го типа (Th1) и первичному нарастанию Т-хелперов 2-го типа (парадигма Th1/Th2). В острой фазе атопического дерматита Th2-лимфоциты продуцируют цитокины — интерлейкины ИЛ-4 и ИЛ-13, стимулируя синтез аллергенспецифических IgE-антител, а ИЛ-5 способствуют созреванию эозинофилов и их выходу из костного мозга. Однако цитокиновый профиль воспаленной кожи со временем и течением болезни существенно изменяется. В хронической фазе атопического дерматита начинают преобладать активированные Th1-лимфоциты, экспрессирующие мРНК для таких цитокинов, как интерферон, ИЛ-12.
В настоящее время рассматривается роль toll-подобных рецепторов (TLR) в патогенезе атопического дерматита. TLR — это клеточные рецепторы, которые являются частью иммунной системы, а именно врожденного иммунитета. Показано, что воспалительный ответ, запускаемый различными микроорганизмами, связан с активацией TLR при атопическом дерматите. TLR экспрессируются на кератиноцитах, клетках Лангерганса, макрофагов, моноцитах, гранулоцитах. Данные рецепторы распознают патоген-ассоциированные молекулярные паттерны микроорганизмов [4].
TLR содержат лейцин (внеклеточный домен), который распознает лиганды микробных структур. TLR обладают также внутриклеточным доменом. гомологичным цитоплазматическому домену рецептора ИЛ-1 и белка MyD99 (toll-IL-IR, TIR), который участвует в индукции клеточного ответа, опосредованного выработкой провоспалительных цитокинов и антимикробных пептидов.
В процессе связывания молекулярных фрагментов патогена с внеклеточным доменом TLR изменяется конформация внутриклеточго домена, запускается последовательность сигналов, что в конечном итоге приводит к высвобождению различных цитокинов и антимикробных пептидов (дефензины и кателицидины). TLR2 специфичен к грамположительным микроорганизмам, при активации этих рецепторов запускается воспалительный ответ, который сопровождается выработкой ИЛ-9, ИЛ-1, ИЛ-6 [5].
Атопический дерматит помимо воспаления характеризуется поврежденным кожным эпидермальным барьером (генетически детерминированная потеря функции гена филаггрина) и склонностью кожи к инфекциям, а именно к Staphilococcus aureus.
Эпидермальный барьер состоит из корнеоцитов и системы липидов (церамиды, холестерин и свободные жирные кислоты), заполняющих промежутки между корнеоцитами и сохраняющих целостность рогового слоя, что препятствует потере воды и, в конечном итоге, защищает от воздействия патогенных факторов. Липидные структуры кожи, участвующие в построении и регуляции функции эпидермального барьера, обладают мощным антимикробным действием. Кислая среда (рН 5,5) на поверхности кожи благоприятствует синтезу липидов, препятствует заселению патогенными микроорганизмами. Повышение рН и изменение проницаемости кожи способствует развитию вторичной инфекции, которая в свою очередь нарушает барьерные функции кожи. Поврежденные клетки эпидермиса не могут обеспечить полное восстановление липидного барьера, поэтому эпидермис постепенно обезвоживается, что клинически проявляется сухостью, шелушением, зудом и становится основной причиной страдания больного с длительно текущим атопическим дерматитом [6].
Таким образом, мультифакторный патогенез атопического дерматита, системность и полиорганность поражения при этом заболевании обуславливают необходимость комплексного подхода к его терапии. Терапия больных атопическим дерматитом направлена на подавление иммунного воспаления в коже и уменьшение воздействия причинных факторов. Она складывается из диетотерапии и мероприятий по контролю окружающей среды, системной фармакотерапии, наружной терапии и реабилитации. Одно из ведущих мест в комплексном лечении атопического дерматита занимает наружная терапия, целью которой является устранение симптомов заболевания с помощью системы противовоспалительных и увлажняющих средств. Современная терапия атопического дерматита в основном имеет симптоматическую направленность, увлажнение кожи и облегчение зуда.
Стандартом противовоспалительной наружной терапии у больных атопическим дерматитом являются топические кортикостероиды, особенно при тяжелом течении болезни. Несмотря на огромный опыт применения топических кортикостероидов при атопическом дерматите, их доказанную клиническую эффективность, многие аспекты их использования остаются до конца нерешенными. До сих пор присутствует «стероидофобия» как со стороны родителей больных детей, так и со стороны врачей. Часто возникают вопросы о выборе топических кортикостероидов у детей, именно какому препарату следует отдавать предпочтение, как часто и длительно их можно использовать. Учитывая вероятность развития побочных эффектов, связанных с длительным применением, топические кортикостероиды не считаются подходящими препаратами для поддерживающей терапии, особенно при подостром периоде и ремиссии заболевании.
При атопическом дерматите, особенно при склонности кожи к вторичному инфицированию, в качестве противовоспалительного средства, не содержащего кортикостероидов, используется гамма средств: крем Cu-Zn+ и спрей Cu-Zn+ (при экссудации и мокнутии). Дифференцированный подход к назначению этих средств существенно увеличивает приверженность больных к наружной терапии и повышает эффективность лечения.
Крем Cu-Zn+ эмульсия «вода в масле» содержит термальную воду Урьяж, а также инновационный противовоспалительный комплекс TLR2-Regul, глюконаты меди и цинка. Входящие данные компоненты оказывает антисептическое действие за счет влияния меди и цинка на микрофлору кожи, в частности Staphilococcus aureus и Pityrosporum ovale. При этом подавляется их рост, поддерживается физиологический баланс рН на поверхности кожи, восстанавливается нарушенный гидролипидный слой, усиливается барьерная функция кожи. Регулирующий комплекс TLR2-Regul уменьшает выброс противовоспалительных цитокинов, особенно ИЛ-8, и подавляет воспаление, вызванное микроорганизмами путем блокирования toll-подобных рецепторов (TLR2). Силикаты и гидрогенизированный полидецен, способствующий легкому распределению косметических средств на коже, формируют защитную олеоминеральную оболочку, что усиливает барьерную функцию кожи.
Спрей Cu-Zn+ со смектином применяется для участков экссудации. Он обладает подсушивающим действием за счет смектина, а также противовоспалительным эффектом благодаря наличию TLR2-Regul регулирующего комплекса и антисептическим действием за счет глюконата меди и цинка.
Гель Cu-Zn+ наносится на поврежденные участки кожи как очищающее средство ежедневно с последующим применением ванны с температурой воды 37 °С.
Важным и обязательным этапом наружной терапии атопического дерматита является восстановление целостности рогового и водно-липидного слоев кожи с помощью увлажняющих и питательных средств. Этот этап наружной терапии направлен на гидратацию и питание кожи с использованием увлажняющих и питательных средств (эмолентов). Эти средства наносятся на кожу регулярно, ежедневно, не менее 2 раз в день, как на фоне применения топических кортикостероидов, так и в период ремиссии заболевания. Для этого этапа наружной терапии относятся эмоленты: универсальный крем Ксемоз, а для очень сухой кожи Ксемоз Церат. Это комплексы Церастерол-2F и термальной воды Урьяж (30%). Церастол 2F является оригинальной комбинацией липидов, состоящей из ω-жирных кислот: ω-3-церамиды, ω-6-церамиды и фитостерола PhSt, которые встраиваются в структуру биомембран клеток кожного барьера, действуют патогенетически, восстанавливая и усиливая гидролипидный слой кожи, обеспечивая ее питание. Наличие термальной воды Урьяж в составе крема обеспечивает интенсивное увлажнение кожи, что способствует усилению барьерной функции кожи и продлению ремиссии атопического дерматита.
Обязательным звеном наружной терапии атопического дерматита является правильный ежедневный уход за кожей больных детей — ежедневное очищение кожи с использованием мягкой моющей основы, что повышает патологические изменения в эпидермисе, восстанавливает его функции и предупреждает обострение болезни. Для очищения очень сухой кожи используется крем-гель без мыла Ксемоз Синдет, содержащий липидный комплекс Церастерол-2F и термальную воду Урьяж (30%). Он легко смывается, очищает кожу без пересушивания, не разрушает гидролипидный слой, смягчает и увлажняет кожу.
Таким образом, программа ухода за кожей детей с атопическим дерматитом имеет большое значение для достижения ремиссии заболевания и поддержания контроля за течением заболевания. Она включает в себя следующие этапы:
1) очищение кожи (очищающие лосьоны или молочко для сверхчувствительной кожи);
2) базовый уход (термальная вода);
3) лечебный уход во время и после обострений атопического дерматита (успокаивающий крем и крем, снижающий зуд кожи);
4) лечебно-профилактический уход в период ремиссии заболевания.
Такой подход обеспечивает длительный безопасный контроль над воспалением кожи, что обеспечивает стойкую ремиссию болезни, предупреждает ее рецидивирование и существенно улучшает качество жизни больных.
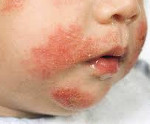
Приводим собственное клиническое наблюдение за ребенком, поступившим в отделение аллергологии с жалобами на кожные высыпания, выраженный зуд кожных покровов и сухость (рис. 1). Из анамнеза известно, что ребенок от первой беременности, протекавшей на фоне токсикоза в I триместре (тошнота, рвота). Роды в срок, затяжные, стимулированные, головное предлежание. Вес при рождении 3850 г, рост 54 см. К груди была приложена сразу. Вакцинация в роддоме. Грудное вскармливание по требованию до 4,5 мес. Перенесенные заболевания: острое респираторное заболевание (ОРЗ) однократно. На момент поступления получала сывороточный гидролизат.
.jpg)
Состояние ребенка средней степени тяжести. Рост 70 см, вес 9 кг. На фоне общей бледности, на коже щек, туловища, рук, ног мелкие папулезные высыпания розового цвета, местами сливающиеся, корочки. Эритема кожи щек. Общая сухость кожи, следы от расчесов, элементы инфицированности. По органам без отрицательной динамики.
Проведенное обследование показало, что в общем анализе крови: гемоглобин 120 г/л ↓ (N 130–160), гематокрит 0,371 ↓ (N 0,400–0,480), эозинофилы 12,5% ↑ (N 0,5–5,0). Остальные показатели в пределах нормы.
Биохимический анализ крови: все показатели в пределах нормы (билирубин, аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза, глюкоза). Общий анализ мочи: прозрачность — слабо-мутная, лейкоциты 7–9 в поле зрения, соли — мочевая кислота (умеренно). Анализ крови на общий IgE: 43,86 ↑ МЕ/мл (норма до 15). Иммунологическое исследование крови: IgG (г/л) 2,43 ↓ (N 7,0–16,0), IgМ (г/л) 0,206 ↓ (N 0,4–2,3), IgА (г/л) 0,231 ↓ (N 0,7–4,0). Аллергологическое исследование крови: IgE: белок коровьего молока — +3, α-глобулин — +2, β-глобулин — +2, казеин — 3, соя — +2, козье молоко — 0.
УЗИ органов брюшной полости: без патологии.
До начала терапии и спустя 2 и 4 недели лечения у ребенка было проведено измерение влажности кожи с помощью корнеометра Skin Diagnostic SD 27, Courage+Kazarka electronic, Германия) на 4 участках тела при температуре окружающей среды +22 °С. Оценка влажности кожи осуществлялась по стандартной шкале, описанной в инструкции, приложенной к прибору (табл.).
У ребенка отмечалась сухая кожа на сгибательной поверхности рук (21 балл), наружной поверхности бедра (17 баллов).
Ребенок получал следующее лечение: режим общий; гипоаллергенную диету с переводом с «сывороточной смеси» на смесь Нэнни и введением в рацион питания мяса и овощного пюре; антигистаминный препарат (Зиртек). Наружная терапия была представлена следующими средствами: метиленовый синий (на следы расчесов 2 дня), крем Cu-Zn+ и термальную воду Урьяж 2 раза в день в течение 7 дней, затем был применен универсальный крем Ксемоз с термальной водой Урьяж.
На фоне проводимого лечения отмечалась положительная динамика, исчезновение кожных высыпаний и сухости кожи (рис. 2).
.jpg)
Ребенок выписался домой в удовлетворительном состоянии с ремиссией атопического дерматита. Даны рекомендации продолжить уход за кожей увлажняющими и питательными средствами наружной терапии.
Таким образом, современная терапия атопического дерматита предусматривает использование широкого круга терапевтических мероприятий, направленных на купирование острых проявлений болезни, и назначение базового ухода за кожей.
Литература
- Аллергические заболевания у детей и окружающая среда. Под ред. В. А. Ревякиной, О. К. Нетребенко, М.: ООО «НьюИнформ», 2005, 237 с.
- Bieber T. Atopic dermatitis // Ann.Dermatol. 2010. V. 22. P. 125–137.
- Ревякина В. А. Атопический дерматит у детей. Современные проблемы // Фарматека, 2012. № 6. С. 34–38.
- Hermann N., Koch S., Leb., N. Bedorf J., Wilms H., Schnatz H., Fimmers R., Bieber T. TLR2 down-regulates FcεRI and its transcription factor PU.1 in human Langerhans cells // Allergy. 2013. V. 68. № 5. p. 621–629.
- Bieber T. The pro-and anti-inflammatory properties of human antigen-presenting cells expressing the high receptor for IgE (fc epsilon RI) // Immunology. 2007. 212. 499–503.
- Кочергин Н. Г. Кожный барьер, ксемоз и купероз // Российский аллергологический журнал // 2013. № 6. C.9–13.
В. А. Ревякина, доктор медицинских наук, профессор
ФГБУ НИИ питания РАМН, Москва
Контактная информация: 5356797@mail.ru
Купить номер с этой статьей в pdf