Монтелукаст при атопическом дерматите
Эффективность Синглона (монтелукаст) в лечении атопического дерматита у детей Муратова Ж. К.
Муратова Жанара Кочкоровна /Muratova Zhanara Kochkorovna — соискатель, медицинский факультет, Ошский государственный университета, г. Ош, Кыргызская Республика
Аннотация: представлены новые сведения по использованию ингибитора лейкотриеновых рецепторов — Синглона (монтелукаст) при лечении атопического дерматита у детей.
Abstract:presented new data on the use of an inhibitor ofleukotriene receptor — singlon (montelukast) in the treatment of atopic dermatitis in children.
Ключевые слова: атопический дерматит, дети, лечение, ингибитор лейкотриеновых рецепторов, Синглон. Keywords: atopic dermatitis, children, treatment, an inhibitor ofleukotriene receptors, singlon.
По данным Всемирной организации по аллергии [11], распространенность аллергических заболеваний во всем мире приобретает катастрофические масштабы, причем как в развитых, так и в развивающихся странах. Чрезвычайно серьезной стала проблема аллергии в детском возрасте — за последние 20 лет рост ее распространенности у детей выражен в особенной степени [1, 2, 3, 8, 9, 12, 14].
Как известно, наряду с ведущей ролью гистамина чрезвычайно важную роль в развитии атопического дерматита (АД) играют липидные медиаторы аллергии — лейкотриены (LT) (табл. 1).
Таблица 1. Медиаторы симптомов атопического дерматита
Заболевание и симптомы Патофизиологический механизм Предполагаемые медиаторы
Зуд кожи, экзема, сухость кожи, лихенизация Аллергическое воспаление и нарушение барьерной функции кожи Гистамин, эйкозаноиды, фактор активации тромбоцитов
Источником LT является арахидоновая кислота, образующаяся из мембранных фосфолипидов под влиянием фермента фосфолипазы А2 в результате воздействия на мембрану клеток различных повреждающих агентов [7]. В таблице 2 описаны основные биологические эффекты лейкотриенов.
Представления о лейкотриенах как о медиаторах воспаления позволили разработать концепцию создания нового класса лекарств, получивших название «антилейкотриеновые субстанции». Среди новых препаратов, контролирующих течение атопического дерматита, все более заметную роль в мире как средство базисной противовоспалительной терапии играют модификаторы лейкотриенов (в частности, монтелукаст — Синглон) [4, 5, 6]. Установлено, что лейкотриены связываются рецепторами, локализованными на плазматических мембранах клеток.
Таблица 2. Некоторые биологические эффекты лейкотриенов
Эйкозаноид Биологическое действие
ЛТВ4 Является сильным хемотаксическим агентом для нейтрофилов, эозинофилов и моноцитов. Синергично с другими медиаторами увеличивает проницаемость сосудов (особенно в присутствии ПГЕ2).
SRS-A: ЛТ С4 ЛТ Д4 ЛТ Е4 Вызывает вазоконстрикцию. Повышает проницаемость системных сосудов (вследствие сокращения терминальных артериол и дилатации венул). Повышает проницаемость мелких сосудов. Участвует в иммунных реакциях
5-ГЭТЕ 15-ГЭТЕ Активирует нейтрофилы и эозинофилы. Потенцирует освобождение медиаторов из тучных клеток.
В Кыргызской Республике модификаторы лейкотриенов до сих пор назначаются редко, несмотря на большое число пациентов (детей и взрослых) с аллергическими заболеваниями, которым они показаны [2, 3]. Существуют два различных типа лейкотриен-модулирующих препаратов — ингибитор 5-липооксигеназы зилеутон и антагонисты лейкотриеновых рецепторов монтелукаст (Синглон) и зафирлукаст.
В Кыргызской Республике зарегистрирован дженерик монтелукаста — Синглон (Gedeon Richter Plc., Венгрия). Препарат для детей выпускается в виде жевательных таблеток по 4 и 5 мг в таблетках, покрытых оболочкой. Монтелукаст (Синглон) обладает пероральной активностью, с высокой степенью сродства и избирательностью связывается с CysLT-1 рецептором.
К сожалению, в русскоязычной доступной медицинской литературе практически не встречается работы по применению антилейкотриеновых препаратов при атопическом дерматите в детском возрасте [13].
Следовательно, информация о новой стратегии лечения наиболее распространенных аллергических заболеваний, представленная в данном обзоре, представляет большой научно -практический интерес для широкой медицинской общественности, включая педиатров, терапевтов, семейных врачей, аллергологов.
Цель исследования заключалась в оценке клинической эффективности антилейкотриенового препарата Синглона в комплексной терапии атопического дерматита у детей.
С целью реализации вышеописанной цели перед нами была поставлена задача — оценить клиническую эффективность и безопасность на фоне терапии препаратом Синглона по данным динамики клинических проявлений атопического дерматита и индекса SCORAD.
Материал и методы
Под нашим наблюдением находились 32 пациента, страдающих атопическим дерматитом. Среди них было 20 девочек и 12 мальчиков в возрасте от 6 до 14 лет. У всех пациентов имелись признаки экзацербации кожного процесса, постоянный зуд, повышенная возбудимость, беспокойство. У 22 детей сильный зуд приводил к расстройству сна. Диагноз впервые был установлен от 2 нед. до 8 лет тому назад.
В клинической картине АД у детей преобладали генерализованные формы (58%) в виде экссудативного (55,9%), эритематозно-сквамозного с лихенизацией (24,7% и эритематозно-сквамозного 19,3%) вариантов течения.
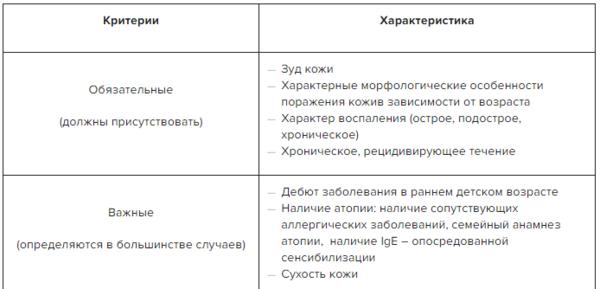
При постановке диагноза во всех случаях ориентировались на следующие признаки [1, 2]:
— наличие заболевания в раннем возрасте;
— наличие аллергических заболеваний у родителей и/или родственников пробанда;
— зуд кожных покровов разной интенсивности;
— типичная морфология кожных высыпаний в виде стойкой гиперемии или преходящей эритемы, папуловезикулезных высыпаний на эритематозном фоне с экссудацией или инфильтрации, сухости кожи, шелушения, лихенификации;
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
— типичная локализация поражения кожных покровов;
— хроническое рецидивирующее течение;
— высокий уровень общего ^Е в сыворотке крови.
По данным аллергологического обследования у 32,2% детей с АД наблюдалось повышенное содержание общего ^Е в сыворотке крови. Уровень общего ^Е в сыворотке крови колебался от 215 до 3084 МЕ/мл (в среднем составил 547,7±5.93).
16 из 32 пациентов ранее получали повторные курсы терапии, включавшие антигистаминные препараты, пробиотики, пребиотики, наружные противовоспалительные средства, включая топические глюкокортикоидные препараты.
Клинические проявления заболевания соответствовали возрастному периоду пациентов. У 19 детей в возрасте от 6 до 12 лет в клинической картине преобладали лихеноидные папулы сероватого цвета, фолликулярные папулы, экскориации. Патологический процесс был наиболее выражен в локтевых сгибах и подколенных складках, на шее, за ушными раковинами. Выявлялась разной степени выраженности отечность век с углублением естественных складок на них На коже боковых поверхностей туловища, спины распространяются полушаровидные фолликулярные папулы. На кистях имелись инфильтрированные очаги. У 11 из 19 детей в этой группе отмечалась выраженная сухость кожных покровов, явления атопического хгйлита. У 11 пациентов ухудшение течения кожного процесса в холодное время года, улучшение — в летнее. У 3 из 19 детей выраженной зависимости кожного процесса от времени года не отмечалось.
У 13 детей от 12 до 14 лет очаги поражения имели преимущественную локализацию в верхней части тела. Отмечена выраженная лихгнификация в локтевых сгибах, подколенных впадинах На руках очаги выявлялись не только на сгибательной, но и на разгибательной поверхности. Диффузно располагались лихеноидные плоские полигональные и округлые полушаровидные папулы. У 1 девочки наблюдалось ухудшение течения кожного процесса в холодное время года, улучшение — в летнее. У 9 из 13 пациентов выраженной зависимости кожного процесса от времени года не отмечалось, но у 3 из них наблюдалось значительное улучшение состояния после купаний на озере Иссык-Куль в сочетании с солнечной инсоляцией в летнее время.
Критериями включения в настоящее исследование являлись:
1) клинические признаки атопического дерматита в стадии обострения;
2) степень тяжести атопического дерматита от 20 до 60 баллов SCORAD (у пациентов колебалась от 32.5 до 74.4 баллов);
3) возраст старше 4 мес.
Критериями исключения являлись:
1) состояние эритродермии;
2) гиперчувствительность к компонентам применяемых средств;
3) возраст младше 6 лет;
4) терапия системными глюкокортикоидными средствами, средствами, восстанавливающими целостность кожного барьера и увлажняющими в течение предшествующих 4 нед.
В ходе исследования была обязательной регистрация любых нежелательных явлений для дальнейшей оценки безопасности Синглона. Лечение всем пациентам проводилось в стационарных условиях
Синглон назначался внутрь 1 раз в сутки за 1 час до или через 2 часа после приема пищи. Доза для детей в возрасте от 6 до 14 лет составляла одна жевательная таблетка 5 мг в сутки. Индивидуального подбора дозировки для этой возрастной группы не требовалось.
Продолжительность лечения составляла от 10-12 до 30 дней. После выписки из стационара родителям детей с АД рекомендовались принимать препарат в срок до 1 месяца. Оценка клинической эффективности Синглона проводилась через 10 и 30 дней.
Помимо наружной терапии все пациенты получали внутрь антигистаминные средства в возрастных дозировках в течение первых 7-10 дней терапии.
У всех больных, получивших Синглон, в динамике терапии оценивалась тяжесть кожного процесса с использованием стандартизованного индекса SCORAD.
Индекс SCORAD определялся формулой, в которой комплексно учитывались распространенность кожных высыпаний, их морфология, степень выраженности проявлений и тяжесть субъективных ощущений пациента:
А/5+7 В/2+С,
где А — распространенность; В — интенсивность; С — субъективные симптомы.
Распространенность (площадь) поражения (0-100%). Определялась путем использования правила «девяток». Очаги, принимаемые во внимание, имели только воспалительные поражения. Сухая кожа не учитывалась.
Интенсивность (0-18). Оценивался каждый из шести признаков (эритема, отек/образование папул, мокнутие/корки, экскориации, лихенизация, сухость) в средней интенсивности по шкале от 0 до 3 баллов: 0 -отсутствие, 1 — легкий, 2 — среднетяжелый, 3 — тяжелый. Сухость оценивалась на невоспаленной коже.
Субъективные симптомы (0-20): аналогичная шкала (0-10) оценки следующих симптомов: зуд и потеря сна.
В таблице 3 отражена динамика клинических показателей оценки тяжести АД с использованием стандартизованного индекса SCORAD.
Обсуждение
После проведенной терапии у всех пациентов было отмечено уменьшение зуда, эритемы, отечности на 10 -ый день применения Синглона, в дальнейшем регресс высыпаний постепенно продолжался. Ко дню выписки из стационара самочувствие всех детей улучшилось, уменьшилось беспокойство.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Оценка динамики клинических проявлений (по динамическому коэффициенту SCORAD) проводилась на 10 и 30 дни лечения (табл. 3).
Таблица 3. Динамика клинических проявлений АД на фоне терапии Синглоном (в баллах по коэффициенту SCORAD)
Срок обследования Исходные Через Через Через
данные 10 дней 1 мес 3 мес
п — в основной группе 27 24 17 12
п — в контрольной группе 11 11 6 —
М±т индекса SCORAD в основной группе 63,12±4,01 37,4±3,4 12,7±5,6* 9,33±5,22*
М±т индекса SCORAD в
контрольной группе 67,44±5,7 54,07±4,5 21,7±5,8* —
Примечание: * — достоверность различий изучаемых параметров между исходными данными и данными через 10 и 30 дней, а также 3 месяца.
В группе детей, страдающих среднетяжелой степенью тяжести АД, отмечена положительная динамика в течение клинического процесса: к 10 дню зуд прекратился, побледнела эритема, уменьшилось шелушение, не было следов расчесов; к 30 дню — эритема разрешилась, остались очаги лихенизации, сухость кожи и шелушение в периорбитальных областях, нормализовался сон, зуд исчез. Клиническая ремиссия развилась у всех детей.
По окончании курса терапии индекс SCORAD снижался до 4-8 баллов. Терапию все пациенты переносили хорошо, побочных реакций и нежелательных явлений ни в одном случае отмечено не было. Не было отмечено какого-либо отрицательного воздействия проводимой терапии на показатели периферической крови, мочи.
Полученные нами данные позволяют рекомендовать Синглон для продолжительной терапии обострений атопического дерматита у детей в различных возрастных группах
Выводы:
1. Синглон, (Гедеон Рихтер) назначаемый в виде жевательных таблеток эффективен у 72,3% пациентов в возрасте от 6 до 14 лет, страдающих атопическим дерматитом.
2. Клиническая эффективность Синглона сопровождается со снижением индекса SCORAD, сокращением периода обострения и продлением ремиссии атопического дерматита.
4. Комплексная терапия атопического дерматита с включением Синглона детьми переносится хорошо, побочных реакций и нежелательных явлений ни в одном случае отмечено не было. Не было отмечено какого -либо отрицательного воздействия проводимой терапии на показатели периферической крови, мочи.
5. Успех в лечении детей с АД препаратом Синглон может объясняться также с комплексностью проводимой терапии, включающей элиминационные мероприятия, диетотерапию, длительное проведение фармакотерапии, в том числе и наружной, и комплекса реабилитационных мер.
Литература
1. Аллергология и иммунология: клинические рекомендации для педиатров. Под ред. А. А. Баранова и Р. М. Хаитова. — 3-е изд., испр. и доп. — М.: Союз педиатров России, 2011. — 256 с. -2.
2. Атопический дерматит: новые аспекты этиопатогенеза, клиники, диагностики, терапии и профилактики: учебное пособие. Составители: О. Ж. Узаков, Ж. К. Муратова, Б. Д. Кудаяров. — Ош. 2012. — стр. 52.
3. Боронбаева Э. К. Современные методологические аспекты эпидемиологических и клинических исследований аллергической патологии у детей: Автореф. дис. … канд. мед. наук. Бишкек, 2005. 23 с.
4. Василевский И. В., Скепьян Е. Н. Педиатрическая фармакология. — 2007. — № 2. — С.15-21.
5. Василевский И. В., Скепьян Е. Н. ARS Medica. — 2011. — № 3. — С. 159-172.
6. Вознесенский Н. А. Атмосфера. Пульмонология и аллергология. — 2008. — № 3. — С.57-60.
7. Клиническая фармакология: учебник. Под ред. В. Г. Кукеса. — 4-е изд., перераб. и доп. М., 2008. — 1056 с.
8. Левина Ю. Г., Намазова-БарановаЛ. С., ТоршхоеваР. М. и др. Вопросы современной педиатрии. — 2010. — № 6. — С. 45-51.
9. European Allergy White Paper: Research, Epidemiology, Public health, Brussels, 1999.
10. Katzung B.G.,Masters S.B., Trevor A.J. Basic and Clinical Pharmacology, 11 ed. — McGraw-Hill Medical. -2009. — 1200 p.
11. WAO White Book on Allergy 2011. — 2012: Executive Summary.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
12. WeilandSK, Husing A, StrachanDP, RzehakP, Pearce N, and the ISAAC Phase One Study Group. Climate and the prevalence of symptoms of asthma, allergic rhinitis, and atopic eczema in children // Journal of Occupational and Environmental Medicine. 2004; 61: 609-15.
13. Wenzel S.E. Antileukotriene Therapy in Asthma // Principles and Practice, 7th ed. — 2008. — Mosby, Imprint Elsevier. — P.1619-1629.
14. Williams H., Robertson C., Stewart A., et al. Worldwide variations in the prevalence of symptoms of atopic eczema in the International Study of Asthma and Allergies in Childhood // Journal of Allergy and Clinical Immunology. 1999; 103: 125-38.
Источник
Страница 3 из 4
Таблица 2. Некоторые биологические эффекты лейкотриенов
Эйкозаноид | Биологическое действие |
ЛТВ4 | Является сильным хемотаксическим агентом для нейтрофилов, эозинофилов и моноцитов. Синергично с другими медиаторами увеличивает проницаемость сосудов (особенно в присутствии ПГЕ2). |
SRS-A: ЛТ С4 ЛТ Д4 ЛТ Е4 | Вызывает вазоконстрикцию. Повышает проницаемость системных сосудов (вследствие сокращения терминальных артериол и дилатации венул). Повышает проницаемость мелких сосудов. Участвует в иммунных реакциях. |
5-ГЭТЕ 15-ГЭТЕ | Активирует нейтрофилы и эозинофилы. Потенцирует освобождение медиаторов из тучных клеток. |
В Кыргызской Республике модификаторы лейкотриенов до сих пор назначаются редко, несмотря на большое число пациентов (детей и взрослых) с аллергическими заболеваниями, которым они показаны [2, 3]. Существуют два различных типа лейкотриен-модулирующих препаратов — ингибитор 5-липооксигеназы зилеутон и антагонисты лейкотриеновых рецепторов монтелукаст (Синглон) и зафирлукаст.
В Кыргызской Республике зарегистрирован дженерик монтелукаста – Синглон (Gedeon Richter Plc., Венгрия). Препарат для детей выпускается в виде жевательных таблеток по 4 и 5 мг в таблетках, покрытых оболочкой. Монтелукаст (Синглон) обладает пероральной активностью, с высокой степенью сродства и избирательностью связывается с CysLT-1 рецептором.
К сожалению, в русскоязычной доступной медицинской литературе практически не встречается работы по применению антилейкотриеновых препаратов при атопическом дерматите в детском возрасте [13].
Следовательно, информация о новой стратегии лечения наиболее распространенных аллергических заболеваний, представленная в данном обзоре, представляет большой научно-практический интерес для широкой медицинской общественности, включая педиатров, терапевтов, семейных врачей, аллергологов.
Цель исследования заключалась в оценке клинической эффективности антилейкотриенового препарата Синглона в комплексной терапии атопического дерматита у детей.
С целью реализации вышеописанной цели перед нами была поставлена задача — оценить клиническую эффективность и безопасность на фоне терапии препаратом Синглона по данным динамики клинических проявлений атопического дерматита и индекса SCORAD.
Материал и методы
Под нашим наблюдением находились 32 пациента, страдающих атопическим дерматитом. Среди них было 20 девочек и 12 мальчиков в возрасте от 6 до 14 лет. У всех пациентов имелись признаки экзацербации кожного процесса, постоянный зуд, повышенная возбудимость, беспокойство. У 22 детей сильный зуд приводил к расстройству сна. Диагноз впервые был установлен от 2 нед. до 8 лет тому назад.
В клинической картине АД у детей преобладали генерализованные формы (58%) в виде экссудативного (55,9%), эритематозно-сквамозного с лихенизацией (24,7% и эритематозно-сквамозного 19,3%) вариантов течения.
При постановке диагноза во всех случаях ориентировались на следующие признаки [1, 2]:
— наличие заболевания в раннем возрасте;
— наличие аллергических заболеваний у родителей и/или родственников пробанда;
— зуд кожных покровов разной интенсивности;
— типичная морфология кожных высыпаний в виде стойкой гиперемии или преходящей эритемы, папуловезикулезных высыпаний на эритематозном фоне с экссудацией или инфильтрации, сухости кожи, шелушения, лихенификации;
— типичная локализация поражения кожных покровов;
— хроническое рецидивирующее течение;
— высокий уровень общего IgE в сыворотке крови.
По данным аллергологического обследования у 32,2% детей с АД наблюдалось повышенное содержание общего IgE в сыворотке крови. Уровень общего IgE в сыворотке крови колебался от 215 до 3084 МЕ/мл (в среднем составил 547,7±5.93).
16 из 32 пациентов ранее получали повторные курсы терапии, включавшие антигистаминные препараты, пробиотики, пребиотики, наружные противовоспалительные средства, включая топические глюкокортикоидные препараты.
Клинические проявления заболевания соответствовали возрастному периоду пациентов. У 19 детей в возрасте от 6 до 12 лет в клинической картине преобладали лихеноидные папулы сероватого цвета, фолликулярные папулы, экскориации. Патологический процесс был наиболее выражен в локтевых сгибах и подколенных складках, на шее, за ушными раковинами. Выявлялась разной степени выраженности отечность век с углублением естественных складок на них. На коже боковых поверхностей туловища, спины распространяются полушаровидные фолликулярные папулы. На кистях имелись инфильтрированные очаги. У 11 из 19 детей в этой группе отмечалась выраженная сухость кожных покровов, явления атопического хейлита. У 11 пациентов ухудшение течения кожного процесса в холодное время года, улучшение – в летнее. У 3 из 19 детей выраженной зависимости кожного процесса от времени года не отмечалось.
У 13 детей от 12 до 14 лет очаги поражения имели преимущественную локализацию в верхней части тела. Отмечена выраженная лихенификация в локтевых сгибах, подколенных впадинах. На руках очаги выявлялись не только на сгибательной, но и на разгибательной поверхности. Диффузно располагались лихеноидные плоские полигональные и округлые полушаровидные папулы.
Есть вопрос? Задайте его Вашему персональному менеджеру. Служба поддержки призвана помочь пользователям в решении любых проблем, связанных с вопросами публикации своих работ и другими аспектами работы издательства «Проблемы науки».
Источник