Проактивная терапия атопического дерматита

Т.В. Проценко, д.м.н., профессор,
зав. кафедрой,
О.А. Проценко, к.м.н., доцент,
А.С. Черновол
кафедра дерматологии
с курсом косметологии (ФИПО)
Донецкий национальный медицинский
университет имени М. Горького

Атопический дерматит (АД) до настоящего времени остается одним из наиболее распространенных аллергических дерматозов у детей. Кроме того, с каждым годом увеличивается число взрослых пациентов с данной патологией [2, 5]. Многолетнее хроническое рецидивирующее течение дерматоза, разнообразие и многочисленность провоцирующих факторов в различные возрастные периоды рождают пессимизм у пациентов и некоторых врачей в отношении возможности эффективной терапии данного заболевания. Нерациональное ведение пациентов, особенно в дебюте АД, отсутствие преемственности среди специалистов различного профиля (педиатров, аллергологов, дерматологов, семейных врачей), оказывающих помощь таким больным, приводит к развитию тяжелых инвалидизирующих форм заболевания и/или атопического марша (аллергического ринита, бронхиальной астмы) [5].
Наружной терапии и уходу за кожей придают большое значение на всех этапах ведения больных с АД [3, 4]. Топические кортикостероиды занимают лидирующее место в наружной терапии дерматоза, однако их длительное применение может привести к развитию осложнений, а хроническое течение иммунозависимого воспаления кожи требует в некоторых случаях пролонгированного базового топического лечения [1, 6]. В связи с этим особый интерес представляет проактивная терапия АД, заключающаяся в длительном интермиттирующем применении топического препарата группы ингибиторов кальциневрина – такролимуса [7].
Основанием для проведения проактивной терапии АД являются, с одной стороны, особенности патогенеза дерматоза (генетически обусловленное нарушение барьерной функции кожи, субклиническое воспаление в видимо неизмененной коже, повышенная реактивность клеток Лангерганса и IgE-чувствительных рецепторов, реагирующих даже на субпороговые раздражители); а с другой – механизм действия такролимуса, блокирующего IgE-чувствительные рецепторы на поверхности клеток Лангерганса, что подавляет образование провоспалительных цитокинов. Это позволяет предупредить развитие и контролировать течение иммунозависимого воспаления в атопической коже [7].
Целью работы являлась оценка переносимости и эффективности проактивной терапии у пациентов различного возраста с АД среднетяжелого течения.
Материалы и методы исследования
Под наблюдением находились 52 пациента с АД среднетяжелого течения в возрасте от 3 лет до 21 года, среди них 28 – мужского пола и 24 – женского. Эффективность лечения оценивали в 2 сравниваемых группах. Пациенты (32) 1-й, основной, группы получали вначале традиционную терапию, затем – проактивную терапию, которая включала длительное наружное применение топического препарата такролимус – мази протопик 0,1% (взрослым) или 0,03% (детям) в интермиттирующем режиме. У 20 пациентов 2-й группы (сравнения) применяли только традиционную терапию. Разработанный протокол проведения исследования включал верификацию диагноза и оценку степени выраженности симптомов и тяжести течения АД, обследование с целью выявления и, при необходимости, лечения фоновой соматической патологии, назначение терапии и мониторинг ее эффективности, информированное согласие и обучение пациента (табл. 1).
| До лечения | 14 дней | 1 мес | 3 мес | 6 мес | 12 мес | 18 мес |
| Верификация диагноза | + | ||||||
| Оценка симптомов (SCORAD) и тяжести течения | + | + | + | + | + | + | + |
| Обследование | + | ||||||
| Критерии включения | + | ||||||
| Критерии исключения | + | ||||||
| Назначение лечения | + | ||||||
| Мониторинг эффективности лечения | + | + | + | + | + | + | |
| Проактивная терапия | + | + | + | ||||
| Анализ дневника пациента | + | + | + | + | + | + |
Критерии включения:
• пациенты с АД среднетяжелого течения (индекс SCORAD от 20 до 40) в стадии обострения;
• возраст от 3 до 45 лет;
• информированное согласие больных или их родителей на участие в исследовании.
Критерии исключения:
• больные с АД с индексом SCORAD до 20 или свыше 40;
• тяжелая соматическая патология (болезни печени, почек, сердца, легких, аутоиммунные заболевания);
• системные или кожные инфекционные заболевания;
• применение в течение последних 4 нед топических ингибиторов кальциневрина;
• нежелание пациента/родителей сотрудничать.
Дизайн работы: до начала лечения, в процессе терапии и далее – через 1, 3, 6, 12 и 18 мес все пациенты проходили дерматологический осмотр с целью определения состояния кожи, степени выраженности симптомов болезни по системе SCORAD.
Лечение пациентов включало 2 этапа. На первом этапе активную терапию обострения АД проводили всем 52 больным одинаково. Наружная терапия включала базовый лечебный уход за кожей: в зависимости от степени выраженности сухости кожи применяли локобейз липокрем или локобейз рипеа. На очаги микробного воспаления наносили пимафукорт крем 2 раза в сутки в течение 7–10–14 дней, затем, при сохранении воспалительной инфильтрации или лихенификации, а также изначально при отсутствии микробного компонента, – гидрокортизона-17 бутират (локоид) в лекарственной форме, адекватной морфологии высыпаний: крем – при экссудативной и островоспалительной инфильтрации; липокрем или мазь – при лихенификации, воспалительной инфильтрации; локоид крело – на высыпания в складках, волосистой части головы или при экссудативной инфильтрации. После регресса островоспалительных явлений на места «фиксированных» высыпаний (воспалительной инфильтрации и лихенификации) применяли топический ингибитор кальциневрина – такролимус – мазь протопик 0,03% (детям) и 0,1% (взрослым) 1 раз в сутки вечером в течение 2–4 нед до полного регресса воспалительных явлений. Системная терапия включала антигистаминные препараты II или III поколения (левоцетиризин, кетотифен, дезлоратадин), сорбенты, пребиотики, гепатопротекторы.
Второй этап лечения включал проактивную терапию, которую проводили только больным основной группы: на места «фиксированных» высыпаний продолжали применять в интермиттирующем режиме мазь протопик 0,03% (детям) и 0,1% (взрослым): 1 раз в сутки, вечером, 2 раза в неделю в течение 3–6 мес.
Эффективность терапии оценивали по динамике регресса симптомов заболевания, продолжительности ремиссии и числу рецидивов в течение 18 мес наблюдения.
Статистическую обработку результатов проводили по стандартной методике на персональном компьютере.
Результаты исследования и их обсуждение
В исследовании незначительно преобладали пациенты с АД возрастной группы 7–18 лет: 20 (38,5%) больных (табл. 2).
| Основная группа | Группа | Всего, абс./% |
| 3–7 лет | 8 | 6 | 14/26,9 |
| 7–18 лет | 14 | 6 | 20/38,5 |
| Старше 18 лет | 10 | 8 | 18/34,6 |
| Всего | 32 | 20 | 52/100 |
В исследование были включены только пациенты со среднетяжелым течением АД, с индексом SCORAD от 26,6 до 39,8 балла (в среднем 35,4±1,5 балла), который был наиболее выраженным в возрастной группе 18 лет и старше (в среднем 39,1±1,35 балла; табл. 3). Обе группы были репрезентативны по данному показателю.
Возраст | Основная группа | Группа | Всего |
Число пациентов/индекс SCORAD | |||
| 3–7 лет | 8/29,2±1,15 | 6/28,9±2,1 | 14/29,1±1,95 |
| 7–18 лет | 14/38,8±1,45 | 6/37,4±1,91 | 20/38,1±1,21 |
| Старше 18 лет | 10/39,6±1,25 | 8/38,4±1,5 | 18/39,1±1,35 |
| Всего | 32/35,9±1,35 | 20/34,9±1,6 | 52/35,4±1,5 |
Переносимость топического ингибитора кальциневрина – протопика у всех пациентов была удовлетворительной. Аллергических или каких-либо других реакций, требующих отмены препарата, не наблюдали ни у одного из 52 пациентов. Четверо пациентов отмечали незначительный дискомфорт в виде легкого пощипывания, жжения в течение первых 3–5 дней применения протопика. Эти ощущения проходили спонтанно и не требовали коррекции терапии или отмены препарата. В то же время почти все пациенты при длительном применении отмечали дополнительные смягчающие эффекты препарата, что приводило к уменьшению потребности в использовании смягчающих средств.
Оценка ближайших результатов лечения не выявила принципиальных различий в исследуемых группах. Так, терапевтический эффект установлен уже в конце 1-й недели у всех пациентов в обеих группах. Индекс SCORAD после лечения уменьшился на 80–100% у 43 (82,7%) больных, в том числе у 27 (84,4%) – из основной группы и 16 (80%) – из группы сравнения. Уменьшение индекса SCORAD на 50–79% отмечалось у 3 (9,4%) пациентов основной группы и 3 (15%) – группы сравнения; менее 50% – у 2 (6,2%) больных основной группы и 1 (5%) – группы сравнения.
Клиническая ремиссия через 2 нед достигнута у 14 (43,8%) пациентов основной группы и 12 (60%) – в группе сравнения; через 4 нед – у 30 (93,8%) и 19 (95%) больных соответственно. Анализ ближайших результатов лечения в группах не выявил существенных отличий в его эффективности через 1 мес. Более показательными были отдаленные результаты лечения.
Наиболее отчетливо эффективность проактивной терапии такролимусом наблюдали при последующем ведении пациентов в течение 18 мес. Стойкая клиническая ремиссия в течение 1,5 лет наблюдения отмечена у 8 (25%) больных основной группы и ни у одного из 20 больных группы сравнения. Клиническую ремиссию в течение года наблюдали у 11 (34,4%) пациентов основной группы и только у 3 (15%) – в группе сравнения. Шестимесячная ремиссия отмечалась у 12 (37,7%) больных основной группы и у 9 (45%) – в группе сравнения. Кратковременная ремиссия, в течение 3 мес, отмечена у 8 (40%) больных группы сравнения и лишь у 1 (3,1%) больного основной группы (табл. 4).
Продолжительность ремиссии | Основная группа, n=32, абс./% | Группа сравнения, n=20, абс./% |
3 мес | 1/3,1 | 8/40 |
6 мес | 12/37,7 | 9/45 |
12 мес | 11/34,4 | 3/15 |
18 мес | 8/25 | – |
Особый интерес представляет анализ эффективности проактивной терапии в различных возрастных группах пациентов с АД (табл. 5, 6).
| Возраст | ||
3–7 лет, | 7–18 лет, | Старше 18 лет, n=10 | |
| 3 мес, n=1 | – | – | 1 |
| 6 мес, n=12 | 1 | 8 | 3 |
| 12 мес, n=11 | 1 | 5 | 5 |
| 18 мес, n=8 | 6 | 1 | 1 |
Ремиссия | Возраст | ||
3–7 лет, | 7–18 лет, | Старше 18 лет, n=8 | |
| 3 мес, n=8 | 3 | 2 | 3 |
| 6 мес, n=9 | 1 | 4 | 4 |
| 12 мес, n=3 | 2 | – | 1 |
| 18 мес, n=0 | – | – | – |
Так, 6 из 8 пациентов с АД со стойкой клинической ремиссией в процессе проактивной терапии такролимусом относились к возрастной группе 3–7 лет и лишь по 1 больному – к старшим возрастным группам. Вероятно, раннее начало проактивной терапии в сочетании с проведением обучающих программ (коррекция рациона питания, отслеживание и исключение триггерных факторов и др.) дают возможность изменить течение АД и мотивировать пациентов и/или их родителей к выполнению рекомендаций врача. Обострения АД, которые наблюдали у 24 (75%) больных основной группы, наиболее часто были связаны с погрешностями питания – у 8 (33,3%), ОРВИ на фоне хронической вирусной инфекции – 11 (45,8%), стрессами – 9 (37,5%). Степень выраженности воспалительной реакции кожи во всех этих случаях была во много раз меньше, чем при предшествующем течении дерматоза. Индекс SCORAD во всех наблюдениях не превышал 10 и в среднем составил 9,6±0,8 балла.
При рецидиве дерматоза пациентам назначали коротким курсом топические кортикостероиды (комбинированный – при инфицировании, монокомпонентный – при отсутствии микробного компонента), после регресса остроты воспаления возвращались к применению протопика.
При анализе результатов традиционного подхода к ведению пациентов с АД отмечено, что в течение 6 мес обострения наблюдались у 17 (85%) больных, наиболее часто связанные с ОРВИ на фоне хронической вирусной инфекции – у 9 (52,9%), пищевыми погрешностями – 6 (35,3%), стрессом – 4 (23,5%). При этом степень выраженности воспалительной реакции у большинства из них была такой же, как и при предшествующих обострениях, индекс SCORAD колебался от 22,4 до 36,2 балла и в среднем составил 30,1±1,2 балла.
Таким образом, применение проактивной терапии протопиком продемонстрировало ее хорошую переносимость и высокую эффективность у пациентов с АД во всех возрастных группах, особенно при ее начале в раннем возрасте. Уникальный механизм действия такролимуса, блокирующего рецепторы клеток, вырабатывающих сигнальные молекулы воспаления [7], независимо от того, какой триггер действует: экзогенный или эндогенный, позволяет предупреждать развитие иммунозависимого воспаления в данном участке кожи и/или уменьшать степень его выраженности. Именно с этим связана возможность изменения течения дерматоза. В то же время многофакторность обострений АД в разные возрастные периоды обусловливает необходимость выявления и элиминации всех возможных триггерных факторов воздействия на барьерные ткани (кожа, слизистые оболочки) при каждом обострении дерматоза, а также активного внедрения обучающих программ для пациентов с целью их мотивирования к изменению образа жизни. В этом случае появится возможность «перерасти» болезнь и достичь стойкой ремиссии на годы и десятилетия.
Выводы
1. Применение топических ингибиторов кальциневрина – такролимуса – при АД является эффективным и хорошо переносится пациентами.
2. Проактивная терапия – длительное применение такролимуса (протопик) в интермиттирующем режиме способствует достижению и сохранению стойкой и длительной клинической ремиссии (более 12 мес) у 49,4% больных со среднетяжелым течением АД по сравнению с традиционным лечением (лишь у 15% больных).
3. Проактивная терапия такролимусом может быть вариантом длительной монотерапии АД, особенно у пациентов со среднетяжелым и тяжелым течением дерматоза.
Литература
1. Альтмайер П. Терапевтический справочник по дерматологии и аллергологии. – М.: ГЭОТАР-МЕД, 2011. – 1242 с.
2. Калюжная Л.Д. Современная концепция повседневной терапии атопического дерматита // Укр. журнал дерматології, венерології, косметології. – 2006. – № 3. – С. 56–60.
3. Проценко Т.В. Дифференцированный подход к выбору средств наружной кортикостероидной терапии // Укр. журнал дерматології, венерології, косметології. – 2009. – № 2. – С. 31–34.
4. Смирнова Г.И. Современные технологии местного лечения атопического дерматита // Иммунопатол., аллергол., инфектол. – 2003. – № 3. – С. 75–82.
5. Akdis C., Akdis M., Bieber T. et al. Diagnosis and treatment of atopic dermatitis in children and adult // J. Allergy. Clin. Immunol. – 2007. – N 118. – P. 152–159.
6. Eichenfield I., Charles N., Ellis M. et al. Evaluation of Adrenal suppression of a lipid enhanced, topical emollient cream formulation of hydrocortisone butyrate 0,1% in treating children with atopic dermatitis // Pediatric Dermatology. – 2007. – N 24. – P. 81–84.
7. Thaci D., Reitamo S., Gonzalez Ensenat M.A. et al. Proactive disease management with 0,03% tacrolimus ointment for children with atopic dermatitis: results of a randomized, multicentre, comparative study // Br J Dermatol. – 2008. – N 159. – P. 1348–1356.
В статье рассмотрены современные возможности профилактики атопического дерматита. Показано, что базисный метод профилактики и лечения обострений заболевания и увеличения продолжительности ремиссии заключается в регулярном использовании эмолентов
Введение
Влияние атопического дерматита на жизнь пациента часто недооценивается. Существует диссонанс между оценками тяжести заболевания и влияния патологии на качество жизни самим пациентом и врачом. Зуд, сухость и болезненность кожных покровов, нарушение сна — ключевые симптомы, негативно влияющие на физическое здоровье пациентов как с легким, так и с тяжелым течением заболевания. Данные факторы сказываются на таких ежедневных активностях, как работа, учеба, проведение досуга, прием ванны, надевание одежды, тем самым значительно ухудшают качество жизни пациентов с атопическим дерматитом (рис.1) [1].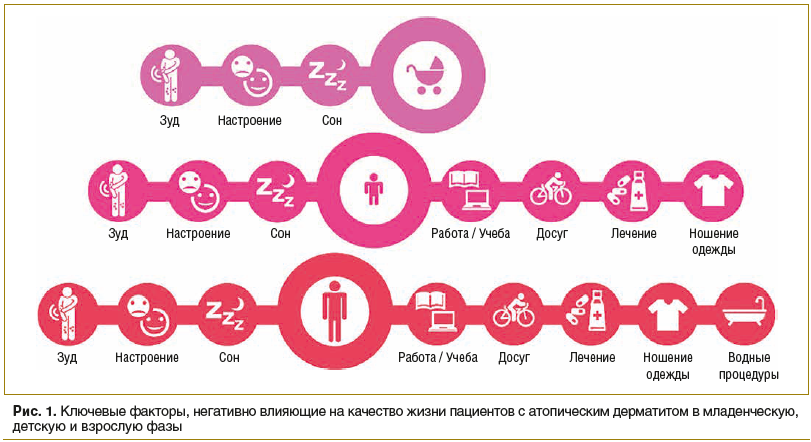
Исследования, проводимые с помощью полисомнографии, анкетирования пациентов и их родителей, актиграфии и видеомониторинга больных во время сна, показали уменьшение эффективности и продолжительности сна, а также увеличение количества ночных пробуждений. Установлено, что в среднем пациенты используют от 11 до 84 мин каждую ночь на устранение кожного зуда, а тяжесть заболевания коррелирует со степенью нарушения сна [2].
Тяжесть течения атопического дерматита ассоциирована с более высоким риском развития коморбидных заболеваний: артрита, аллергического ринита, бронхиальной астмы, аллергического дерматита [3, 4]. У пациентов с атопическим дерматитом выделяют три паттерна проявлений алиментарных аллергических реакций: неэкзематозные реакции, реакции обострения атопического дерматита и их сочетание. Неэкзематозные реакции включают крапивницу, заболевания желудочно-кишечного тракта и респираторной системы. Особенностью данных состояний, обусловленных сенсибилизацией к алиментарным факторам, является развитие клинических проявлений в течение 1–2 ч после экспозиции к аллергену. Simonsen et al. при исследовании 100 детей с атопическим дерматитом путем использования аппликационного теста установили у 47% исследуемых наличие контактной аллергии [2, 4].
Долгое время считалось, что атопический дерматит — в большей степени заболевание детского возраста. Однако исследования последних лет указывают на противоположную тенденцию. Так, Mortz et al. установили сохранение заболевания у 34,1% пациентов во взрослом периоде. Оценка дерматологического индекса качества жизни у взрослых пациентов с атопическим дерматитом во время обострений показала значительное снижение данного показателя у 66% исследуемых. Среди факторов риска перехода заболевания из детской стадии в подростковую и взрослую выделяют: ранний дебют заболевания, наличие аллергического ринита и экземы кистей [5].
Ментальное здоровье также подвергается воздействию атопического дерматита. В детском возрасте пациенты испытывают застенчивость и смущение по поводу своего заболевания. В период зрелости эти комплексы сохраняются и могут манифестировать в виде депрессии и тревожности. Коварство атопического дерматита как фактора развития заболеваний психической сферы заключается в том, что даже легкие формы данной патологии кожи могут выступать в роли триггера нарушений ментального здоровья [1].
Грамотная профилактика атопического дерматита способствует не только снижению частоты развития обострений заболевания, но и уменьшает риск формирования сопутствующих ему коморбидных заболеваний. Токсичность существующей иммуносупрессивной терапии атопического дерматита также указывает на приоритет профилактики данного заболевания [6].
Факторы, влияющие на течение атопического дерматита, его профилактика и лечение
Проактивный режим применения топических противовоспалительных препаратов как средство профилактики обострений атопического дерматита
Частое использование топических противовоспалительных средств необходимо только в случае появления новых высыпаний. Такой режим терапии атопического дерматита называется реактивным. При этом ежедневное использование эмолентов способствует значительному увеличению продолжительности ремиссии.
Другим режимом лечения заболевания является проактивный метод, когда топические глюкокортикостероиды или ингибиторы кальциневрина наносят на ранее пораженные участки кожи, а также на новые очаги продолжительное время после обострения атопического дерматита в интермиттирующем режиме (1–3 р./нед.). Эмоленты при проактивном методе лечения наносят на всю поверхность тела ежедневно [7, 8].
Образовательные программы для пациентов и их родителей
Атопический дерматит — заболевание полиэтиологической природы, лечение которого включает широкий спектр лекарственных и физиотерапевтических средств. Осведомленность пациента о патогенезе заболевания и его течении, о методах и целях лечения способствует улучшению комплаентности, нивелирует ложные предубеждения и тревожность по поводу терапии [7].
Образовательные программы могут проходить в индивидуальном или групповом формате. Самая крупная школа проводилась в Германии в 2007 г., в ней приняли участие 823 пациента. В рамках шестинедельной школы пациентам были прочитаны лекции на тему течения атопического дерматита, особенностей питания пациентов, проводились занятия с психологами, что в результате привело к снижению тяжести заболевания, оцениваемой по шкале SCORAD, по сравнению с группой контроля [9].
Ввиду высокой занятости врачей не всегда возможно проводить дни атопического дерматита в реальном времени. Поэтому другим эффективным образовательным средством для пациентов стали видеолекции врачей-дерматовенерологов, а также веб-семинары и телемедицинские конференции для пациентов, что предположительно также будет способствовать улучшению комплаентности [7].
Аллергены как фактор развития атопического дерматита
Развитие пищевой аллергии в возрасте до 2 лет является фактором риска развития тяжелого атопического дерматита. Многие авторы считают, что определение аллергенов и их устранение из окружающей среды выступает важным компонентом профилактики атопического дерматита. В пользу этого указывают данные о том, что проникновение аллергенов в кожу стимулирует выработку протеиназ эозинофилами. Это способствует формированию зуда, что может привести к развитию очередного обострения заболевания [10]. Для оценки аллергологического статуса пациента используют прик-тест, аппликационный тест, скарификационную пробу и определение уровня специфического иммуноглобулина IgE (табл. 1).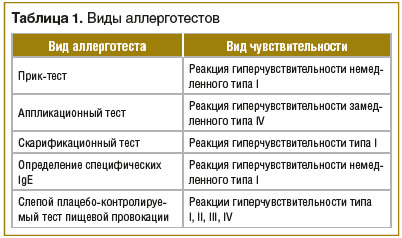
Положительный результат аппликационного теста отражает восприимчивость организма к исследуемому веществу, опосредованную через IgE-зависимую реактивность, однако это не указывает на то, что именно данный аллерген является триггером атопического дерматита. Часто экспозиция аллергена приводит к развитию немедленной реакции I типа с клинической манифестацией в виде крапивницы, зуда, нарушений работы желудочно-кишечного тракта и респираторной системы, анафилаксии, что не соотносится с проявлениями атопического дерматита. Поэтому важно установить не только наличие аллергена, но и то, что именно данный аллерген является фактором развития заболевания: прямым путем через воздействие на иммунные клетки или непрямым путем через усиление зуда [7, 9].
Реактивность к аэроаллергенам возрастает с возрастом. Наиболее часто встречающиеся аэроаллергены — продукты жизнедеятельности клещей домашней пыли, пыльца, пот домашних животных, плесневые грибы. Ингаляция аэроаллергенов приводит к секреции провоспалительных цитокинов у чувствительных пациентов, а контакт с кожей вызывает развитие экзематозной реакции у 5–45% восприимчивых больных атопическим дерматитом. Следует заподозрить наличие восприимчивости к аэроаллергенам, если высыпания у пациентов с атопическим дерматитом локализованы на открытых участках тела: на лице, шее, области декольте, верхних и нижних конечностях [2, 7, 9].
Не рекомендуется назначать всем пациентам с атопическим дерматитом гипоаллергенную диету. Установлено, что при существовании специфических IgE к белку куриного яйца исключение данного продукта из рациона пациентов с атопическим дерматитом приводит к улучшению состояния кожи. Однако другие элиминационные диеты не показали положительных результатов у больных. При подозрении на пищевую аллергию пациенту рекомендуется вести пищевой дневник. При наличии ассоциации обострений заболевания с приемом определенных продуктов рекомендуется исключение данного продукта из рациона на 4–6 нед. Если по истечении данного срока состояние пациента улучшается, необходимо провести слепой плацебо-контролируемый тест пищевой провокации, который является «золотым стандартом» диагностики пищевой аллергии (см. табл. 1).
В рамках приема практикующему врачу необходимо объяснять пациенту, что атопический дерматит — мультифакторное заболевание, в патогенезе которого аллергены играют в некоторых случаях лишь роль одного из триггеров. Поэтому профилактика должна быть комплексной, а не направленной лишь на устранение аллергенов [4, 7, 9].
Пробиотики
Доказано, что прием пробиотиков матерью во время беременности и сразу после родов снижает риск развития атопического дерматита у детей. Качественный состав пробиотиков, а именно включение одного или нескольких видов лактобактерий, не влияет на степень снижения риска развития заболевания. Исследование применения пробиотиков и пребиотиков у детей с атопическим дерматитом не показало значительного влияния на течение заболевания и риск развития обострений [10–14].
Рекомендации по модификации окружающей среды и изменению образа жизни
Важнейшие компоненты профилактики атопического дерматита — модификация окружающей среды, устранение внешних факторов, способных вызвать дебют или обострение заболевания. Окружающая среда, в которой находится беременная, также влияет на возможность развития атопического дерматита у ребенка. Установлено, что у женщин, проживающих в ремонтируемых во время беременности помещениях, риск рождения ребенка с атопическим дерматитом выше, чем в общей популяции. Летучие органические компоненты бытовых веществ способны проникать через плаценту в организм плода, вызывая активацию Th2-лимфоцитов, что лежит в основе патогенеза заболевания. Новая одежда часто содержит большое количество формальдегида, что приводит к раздражению кожи. Поэтому рекомендуется проводить тщательную обработку недавно купленных вещей. Для стирки рекомендуется использовать гелевые стиральные средства, не содержащие фосфатов. Необходимо избегать использования одежды из шерсти, шелка, фланели, т. к. данные материалы оказывают раздражающее действие на кожу. Другой важный фактор внешней среды — температура, оптимальным значением которой является диапазон между 18 и 22 °C. Резкая и частая смена температуры негативно влияет на состояние кожи детей, предрасположенных к развитию атопического дерматита. Низкий уровень влажности воздуха также может выступать в роли триггера атопического дерматита, поэтому зимой необходимо использовать увлажнитель воздуха [1, 8, 11].
Один из возможных триггеров атопического дерматита — экспозиция выделений клещей домашней пыли, чувствительность к которым среди пациентов с данным заболеванием является предметом изучения множества исследований [7, 15–19]. Bremmer et al. провели метаанализ семи рандомизированных контролируемых исследований детей, родители которых проводили специфическую санитарную обработку против клещей домашней пыли, а также использовали антиклещевые чехлы для постельных принадлежностей. Анализ показал отсутствие влияния профилактических мероприятий на вероятность развития атопического дерматита у детей. Можно предположить, что такой результат обоснован либо отсутствием участия выделений клещей домашней пыли в развитии атопического дерматита, либо недостаточностью устранения данного триггера для предотвращения заболевания [15].
Ожирение ассоциировано с более тяжелым течением атопического дерматита. Koutroulis et al. провели исследование 104 пациентов с атопическим дерматитом младше 18 лет. Было выявлено, что среди детей старше 2 лет с индексом массы тела более 24 индекс SCORAD достоверно выше, чем в других группах. Таким образом, раннее выявление и профилактика ожирения у детей предотвращают развитие атопического дерматита и способствуют снижению тяжести заболевания [12]. Оптимальный вид физических нагрузок для таких пациентов — плавание. Данный вид спорта исключает повышенную потливость и раздражение кожи одеждой. Для предупреждения раздражающего действия хлорированной воды необходимо сразу после водных процедур принять душ, а через 3–5 мин на всю поверхность тела нанести эмолент [11].
Восстановление защитных свойств кожи
Несмотря на множество теорий развития атопического дерматита, одним из ключевых факторов формирования данной патологии считается нарушение барьерной функции кожи [6, 20].
Дефекты эпидермиса являются входными воротами для потенциальных аллергенов внешней среды, что может привести к развитию реакции гиперчувствительности I типа, которая лежит в основе атопического дерматита, бронхиальной астмы, аллергического ринита и т. д. Нарушение целости эпидермиса является предрасполагающим фактором для колонизации кожи патогенными микроорганизмами, ферменты которых также повреждают эпидермис. Поэтому базисным методом профилактики, лечения обострений заболевания, а также увеличения продолжительности периода ремиссии является регулярное использование эмолентов, ежедневное нанесение которых на кожу новорожденных достоверно уменьшает риск развития атопического дерматита в будущем в 2 раза [11, 17, 19, 20].
Действующее вещество препарата Д-Пантенол (EGIS Pharmaceuticals PLC) — декспантенол — способствует восполнению субклинической дисфункции кожного барьера, а также предотвращает развитие воспалительной реакции благодаря усилению гидратации кожи и уменьшению проницаемости кожи для аллергенов (рис. 2). Ланолин и белый пчелиный воск, входящие в состав препарата, способствуют восстановлению липидного состава кожи, тем самым усиливают действие основного вещества. Препарат выпускается в двух лекарственных формах: крема и мази. Д-Пантенол является базисной ступенью терапии атопического дерматита согласно Федеральным клиническим рекомендациям по лечению данного заболевания и используется при любой степени тяжести патологии [17, 20].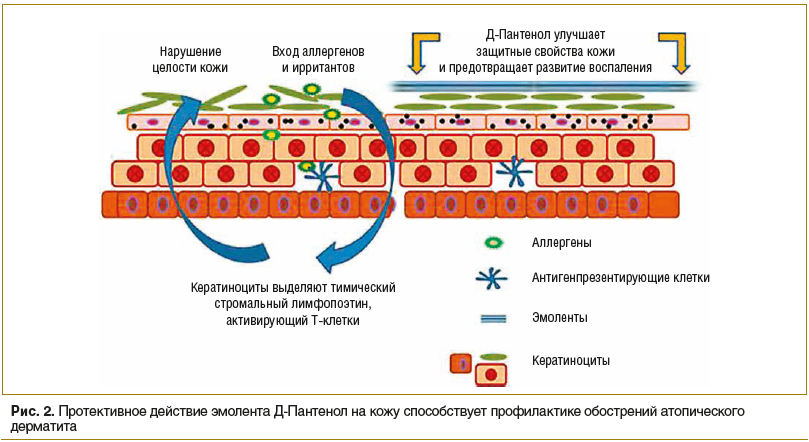
Заключение
Таким образом, профилактика атопического дерматита, ориентированная на ключевые звенья патогенеза, способствует как снижению заболеваемости самим дерматитом, так и уменьшает вероятность появления сопутствующих ему заболеваний. Так как одним из ключевых факторов развития заболевания служит нарушение барьерной функции кожи, то применение эмолентов достоверно уменьшает риск развития атопического дерматита. Современный эмолент Д-Пантенол на основе декспантенола является базисной ступенью терапии и применяется при любой степени тяжести атопического дерматита.


